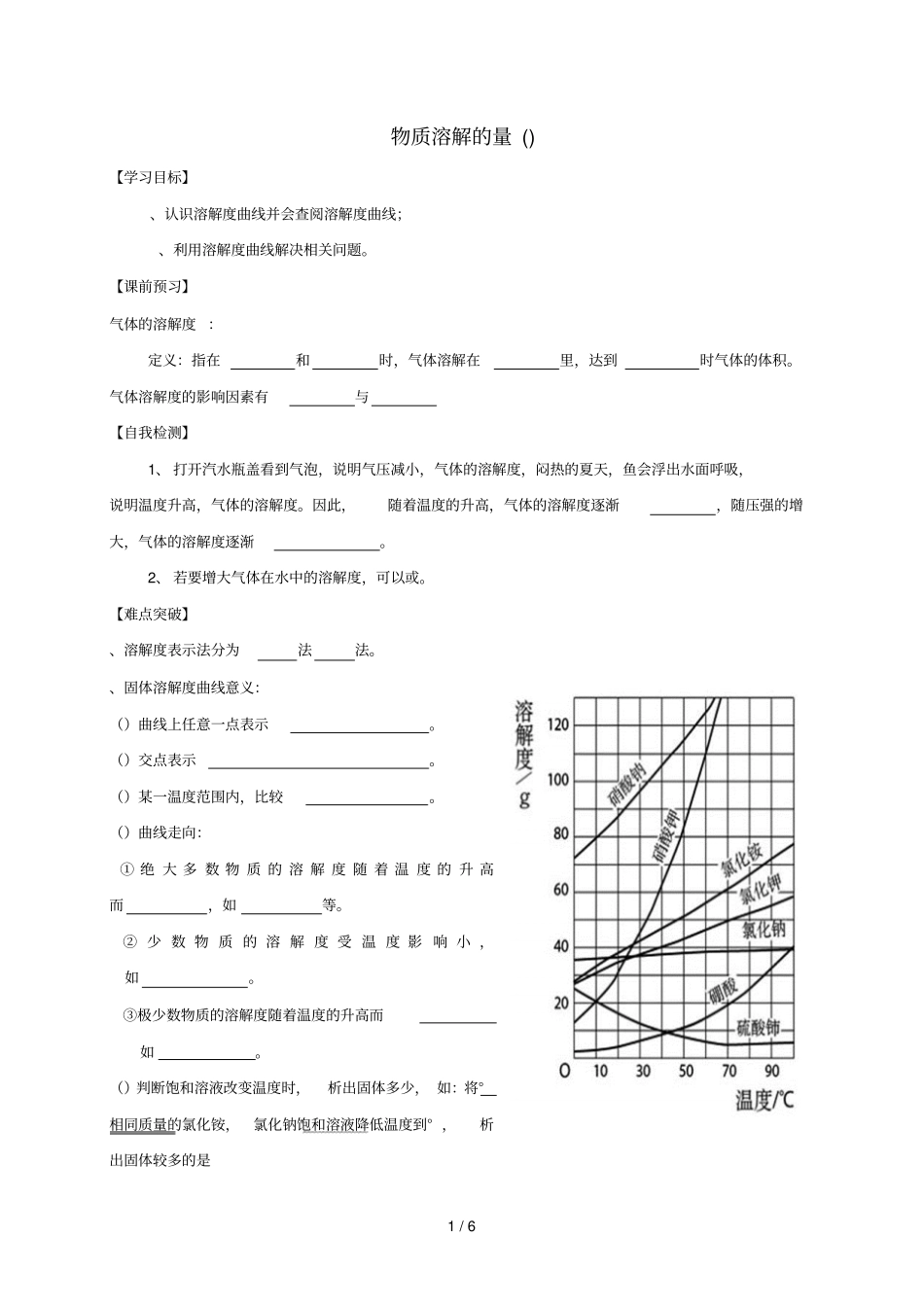
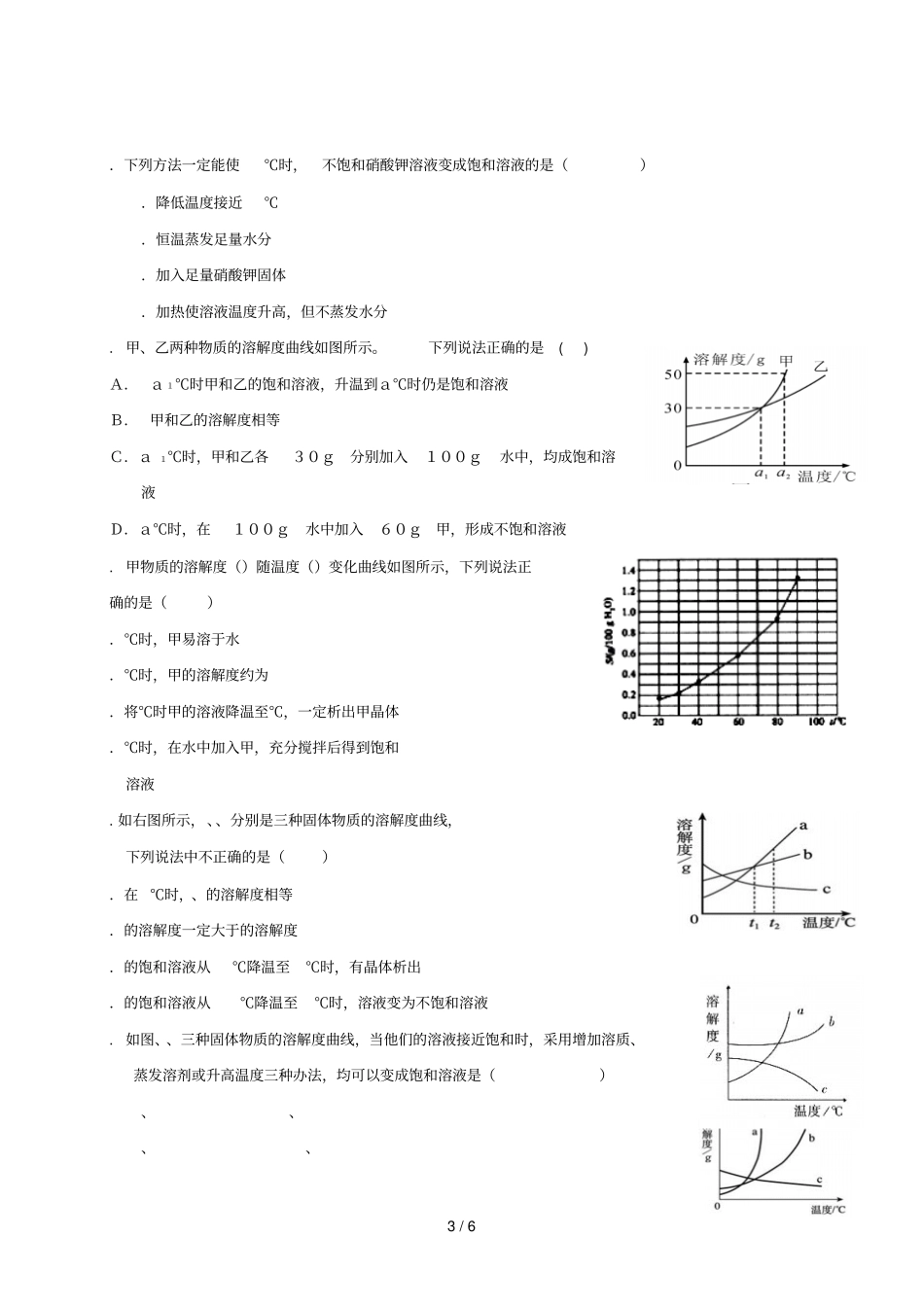
1/6物质溶解的量()【学习目标】、认识溶解度曲线并会查阅溶解度曲线;、利用溶解度曲线解决相关问题。【课前预习】气体的溶解度:定义:指在和时,气体溶解在里,达到时气体的体积。气体溶解度的影响因素有与【自我检测】1、打开汽水瓶盖看到气泡,说明气压减小,气体的溶解度,闷热的夏天,鱼会浮出水面呼吸,说明温度升高,气体的溶解度。因此,随着温度的升高,气体的溶解度逐渐,随压强的增大,气体的溶解度逐渐。2、若要增大气体在水中的溶解度,可以或。【难点突破】、溶解度表示法分为法法。、固体溶解度曲线意义:()曲线上任意一点表示。()交点表示。()某一温度范围内,比较。()曲线走向:①绝大多数物质的溶解度随着温度的升高而,如等。②少数物质的溶解度受温度影响小,如。③极少数物质的溶解度随着温度的升高而如。()判断饱和溶液改变温度时,析出固体多少,如:将°相同质量的氯化铵,氯化钠饱和溶液降低温度到°,析出固体较多的是2/6例:甲、乙两种固体物质的溶解度曲线如图所示,据图回答下列问题:()乙物质的溶解度随温度的升高而(填“增大”或“减小”)。()℃时,甲、乙溶解度大小关系是:甲乙(填“大于”、“小于”或“等于”,下同),℃,甲乙。()℃时,在等质量的水.....中充分溶解甲乙两物质,形成饱和溶液的质量关系:甲溶液乙溶液。()℃时,等含量的甲乙分别配制饱和溶液,需要溶剂的质量关系:甲乙。()℃,甲的饱和溶液降低温度至℃,溶液。()℃,乙的饱和溶液降低温度至℃,溶液。()如何将乙的饱和溶液与不饱和溶液相互转化、溶解度受温度影响不同的物质,饱和溶液与不饱和溶液的转化方法不同()溶解度随温度升高而增大的物质,如硝酸钾(2)溶解度随温度变化不大的物质,如氯化钠()溶解度随温度升高而减小的物质,如()(熟石灰)【随堂练习】一、基础过关.把℃的饱和硝酸钾溶液冷却至室温,下列各种叙述中正确的是().溶剂的总质量保持不变.溶液的总质量保持不变.溶液中溶质的质量保持不变.剩余的溶液一定是饱和溶液3/6.下列方法一定能使℃时,不饱和硝酸钾溶液变成饱和溶液的是().降低温度接近℃.恒温蒸发足量水分.加入足量硝酸钾固体.加热使溶液温度升高,但不蒸发水分.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是()A.a1℃时甲和乙的饱和溶液,升温到a℃时仍是饱和溶液B.甲和乙的溶解度相等C.a1℃时,甲和乙各30g分别加入100g水中,均成饱和溶液D.a℃时,在100g水中加入60g甲,形成不饱和溶液.甲物质的溶解度()随温度()变化曲线如图所示,下列说法正确的是().℃时,甲易溶于水.℃时,甲的溶解度约为.将℃时甲的溶液降温至℃,一定析出甲晶体.℃时,在水中加入甲,充分搅拌后得到饱和溶液.如右图所示,、、分别是三种固体物质的溶解度曲线,下列说法中不正确的是().在℃时,、的溶解度相等.的溶解度一定大于的溶解度.的饱和溶液从℃降温至℃时,有晶体析出.的饱和溶液从℃降温至℃时,溶液变为不饱和溶液.如图、、三种固体物质的溶解度曲线,当他们的溶液接近饱和时,采用增加溶质、蒸发溶剂或升高温度三种办法,均可以变成饱和溶液是()、、、、4/6.右图是、、三种物质的溶解度曲线,现有一定温度下的、、的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是().溶液.溶液.溶液.溶液和溶液.右图是、、三种物质的溶解度曲线与的溶解度曲线相交于点。据图回答:()点的含义是。()℃时物质加入到水中不断搅拌,能形成溶液吗?(填“能”或“不能”)。()℃时,、、三种物质的溶解度按由小到大的顺序排列的是(填物质序号)。.右图为和两种物质的溶解度曲线。()℃时,两种物质溶解度的大小关系为(填“大于”“小于”或“等于”)。()℃时,将固体投入水中,充分溶解后可得到(填“不饱和”或“饱和”)溶液。()将很稀的不饱和食盐水变为饱和食盐水,可行的方法是:①;②。.右图为、两种物质的溶解度曲线。请根据图中内容回答下列问题:()随着温度的升高,物质的溶解度的变化趋势是;()曲线和的交...