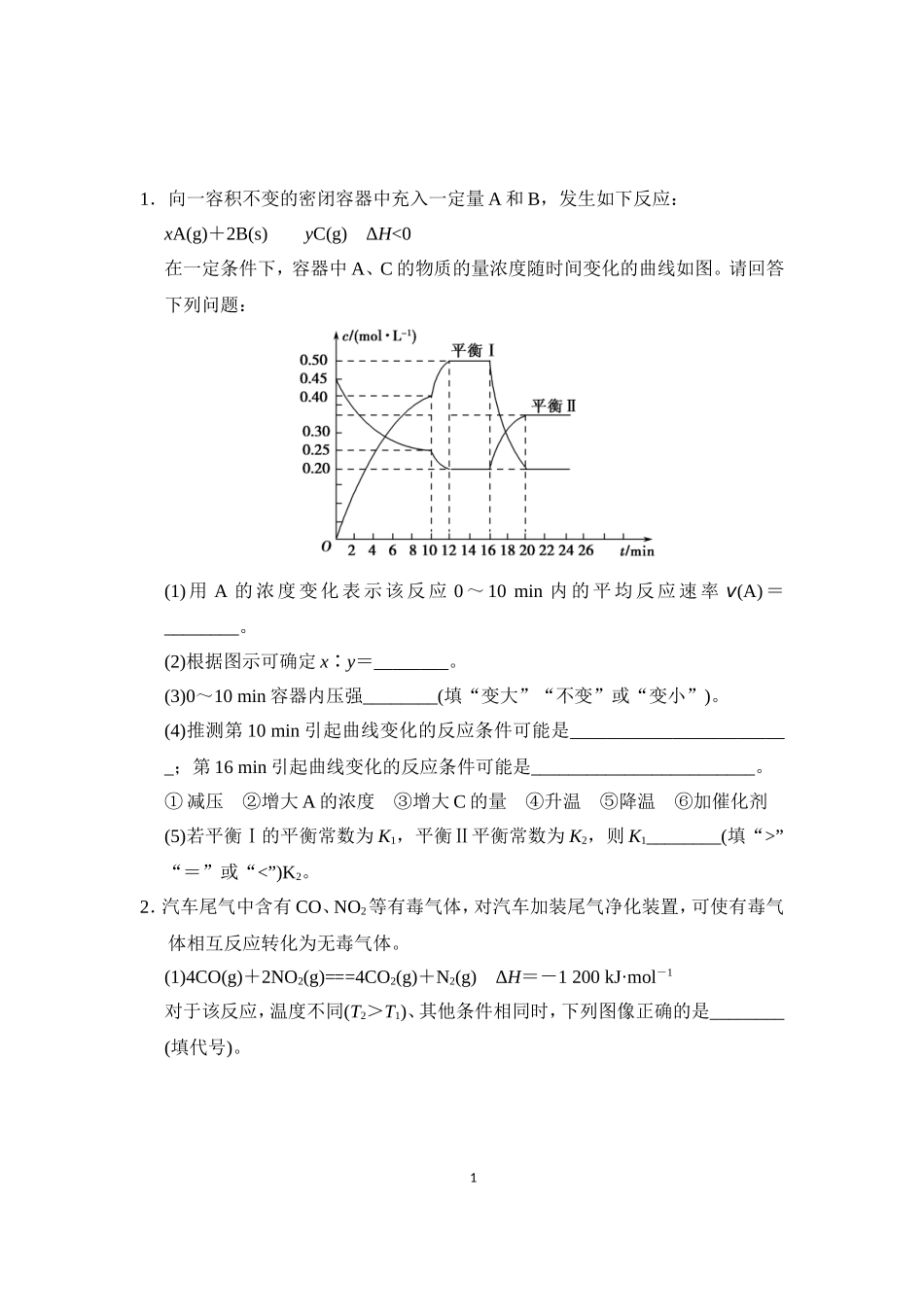
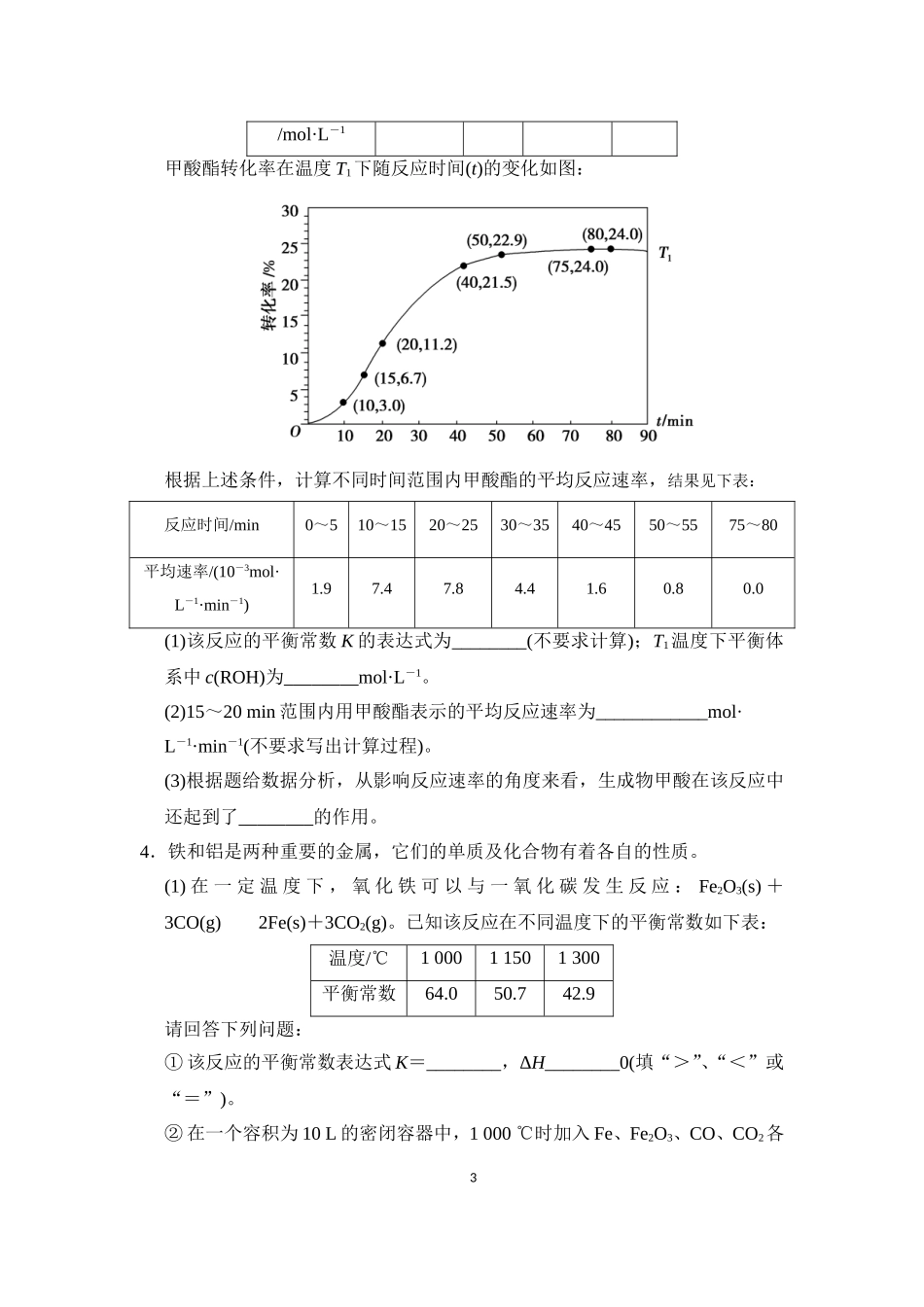
1.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)yC(g)ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图。请回答下列问题:(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=________。(2)根据图示可确定x∶y=________。(3)0~10min容器内压强________(填“变大”“不变”或“变小”)。(4)推测第10min引起曲线变化的反应条件可能是________________________;第16min引起曲线变化的反应条件可能是________________________。①减压②增大A的浓度③增大C的量④升温⑤降温⑥加催化剂(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________(填“>”“=”或“<”)K2。2.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。(1)4CO(g)+2NO2(g)===4CO2(g)+N2(g)ΔH=-1200kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。1(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0。820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。起始物质的量甲乙丙n(H2O)/mol0.100.200.20n(CO)/mol0.100.100.20①该反应的平衡常数表达式为________。②平衡时,甲容器中CO的转化率是________。比较下列容器中CO的转化率乙________甲;丙________甲(填“>”、“=”或“<”)。③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度________(填“升高”或“降低”),平衡常数K________(填“增大”、“减小”或“不变”)。3.某种甲酸酯水解反应方程式:HCOOR(l)+H2O(l)HCOOH(l)+ROH(l)ΔH>0某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:组分HCOORH2OHCOOHROH物质的量浓度1.001.990.010.522/mol·L-1甲酸酯转化率在温度T1下随反应时间(t)的变化如图:根据上述条件,计算不同时间范围内甲酸酯的平均反应速率,结果见下表:反应时间/min0~510~1520~2530~3540~4550~5575~80平均速率/(10-3mol·L-1·min-1)1.97.47.84.41.60.80.0(1)该反应的平衡常数K的表达式为________(不要求计算);T1温度下平衡体系中c(ROH)为________mol·L-1。(2)15~20min范围内用甲酸酯表示的平均反应速率为____________mol·L-1·min-1(不要求写出计算过程)。(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了________的作用。4.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:温度/℃100011501300平衡常数64.050.742.9请回答下列问题:①该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各31.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率为________。③欲提高②中CO的平衡转化率,可采取的措施是________。A.减少Fe的量B.增加Fe2O3的量C.移出部分CO2D.提高反应温度E.减小容器的容积F.加入合适的催化剂(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________。(3)写出氢氧化铝在水中发生酸式电离的电离方程式:______________________________________________________________________________________。欲使上述体系中Al3+浓度增加,可加入的物质是________。5.工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)ΔH(1)能判断反应达到平衡状态的是________(填字母)。A.生成CH3OH与消耗H2的速率比为1∶2B.容器内气体密度保持不变C.容器内气体的平均相对分子质量保持不变D.容器内各种成分的浓度保持不变(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。温度250℃30...