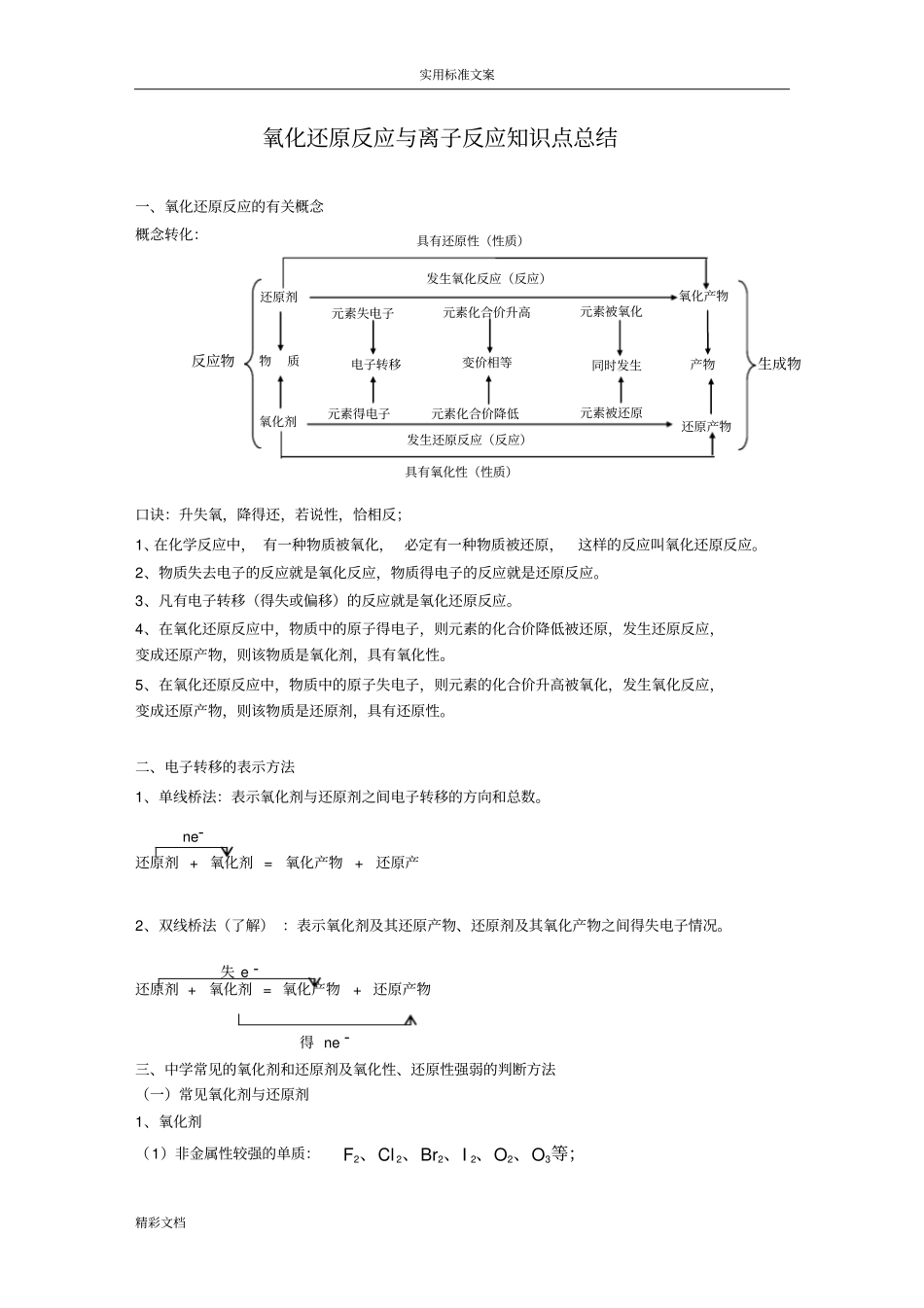
实用标准文案精彩文档氧化还原反应与离子反应知识点总结一、氧化还原反应的有关概念概念转化:口诀:升失氧,降得还,若说性,恰相反;1、在化学反应中,有一种物质被氧化,必定有一种物质被还原,这样的反应叫氧化还原反应。2、物质失去电子的反应就是氧化反应,物质得电子的反应就是还原反应。3、凡有电子转移(得失或偏移)的反应就是氧化还原反应。4、在氧化还原反应中,物质中的原子得电子,则元素的化合价降低被还原,发生还原反应,变成还原产物,则该物质是氧化剂,具有氧化性。5、在氧化还原反应中,物质中的原子失电子,则元素的化合价升高被氧化,发生氧化反应,变成还原产物,则该物质是还原剂,具有还原性。二、电子转移的表示方法1、单线桥法:表示氧化剂与还原剂之间电子转移的方向和总数。2、双线桥法(了解):表示氧化剂及其还原产物、还原剂及其氧化产物之间得失电子情况。三、中学常见的氧化剂和还原剂及氧化性、还原性强弱的判断方法(一)常见氧化剂与还原剂1、氧化剂(1)非金属性较强的单质:等;、、、、、322222OOIBrClF还原剂+氧化剂=氧化产物+还原产物得ne-失e-还原剂+氧化剂=氧化产物+还原产ne-还原剂氧化剂物质产物氧化产物还原产物反应物生成物发生还原反应(反应)具有氧化性(性质)元素化合价降低元素化合价升高具有还原性(性质)发生氧化反应(反应)元素失电子元素得电子元素被氧化元素被还原同时发生电子转移变价相等实用标准文案精彩文档(2)变价元素中高价态化合物:、固体硝酸盐等;、稀、浓、浓、、334272243HNOHNOSOHOCrKKMnOKClO(3)高价态金属阳离子:等;、、23eCuAgF(4)能电离出H+的物质:溶液等;、、稀稀442NaHSOHClSOH(5)其他:等、银氨溶液、新制、、、、漂白粉、2222222aOHCuOHNOONMnOHClO2、还原剂(1)金属性较强的单质:等;、、、、、ZnFeAlMgNaK(2)某些非金属单质:等;、、SiCH2(3)变价金属中某些低价态化合物:及亚硫酸盐等;及其盐、、、盐、及硫化物、、2222SOHIHBrOHFeFeSHCO(4)其他:单质S、Sn2+盐、浓盐酸、NH3等(二)氧化性、还原性强弱的常用判断方法(两种题型考法)1、根据金属活泼性判断金属的金属性越强,单质的还原性越强,其对应离子的氧化性越弱。(1)单质的还原性:按金属活动性顺序依次减弱。(强调顺序)(2)离子的氧化性:按金属活动性顺序依次增强(铁指Fe2+)如氧化性:223FeHCuFeHgAg2、根据非金属的活泼性判断非金属性越强,单质的氧化性越强,其对应离子的还原性越弱。(1)单质的氧化性:SIBrClF2222(2)离子的还原性:FClBrIS23、通过元素周期表判断4、通过化学反应判断实用标准文案精彩文档氧化剂+还原剂氧化产物+还原产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。简记为:左>右。5、通过相近的反应判断如由FeSSFeFeClClFe,32,可得出氧化性:SCl26、有反应条件的难易比较不同氧化剂与同一还原剂反应时,反应条件越易,氧化性越强;不同还原剂与同一氧化剂反应时,反应条件越易,还原性越强。如卤素单质按2222IBrClF、、、的顺序反应条件越来越难,反应条件要求越来越高,则可得出氧化性:2222IBrClF。氧化还原反应专项练习1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是[]A.2F2+2H2O==4HF+O2↑C.2AgNO3+Na2CO3==2NaNO3+Ag2CO3↓2.下列变化属于还原反应的是[]A.Fe——→FeSO4B.Cu(NO3)2——→CuC.P——→P2O5D.NaCl——→AgCl3.下列说法中错误的是[]A.化合反应不一定是氧化还原反应B.分解反应不一定是氧化还原反应C.置换反应一定是氧化还原反应D.复分解反应一定是氧化还原反应4.实现下列反应需加入氧化剂的是[]A.HCl——→CaCl2B.HCl——→H2C.HCl——→Cl2D.HCl——→CO25.下列对氧化还原反应的分析中合理的是[]A.Mg变为MgO时化合价升高,因此Mg在该反应中应中作还原剂B.KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此反应中锰元素既被氧化又被还原C.凡是氧化还原反应能能造福于人类6.某元素在化学反应中由化合态变为游离态,则该元素[]A.一定被氧化B.一定被还原C.既可能被氧化又可能被还原D.以上都不是7....