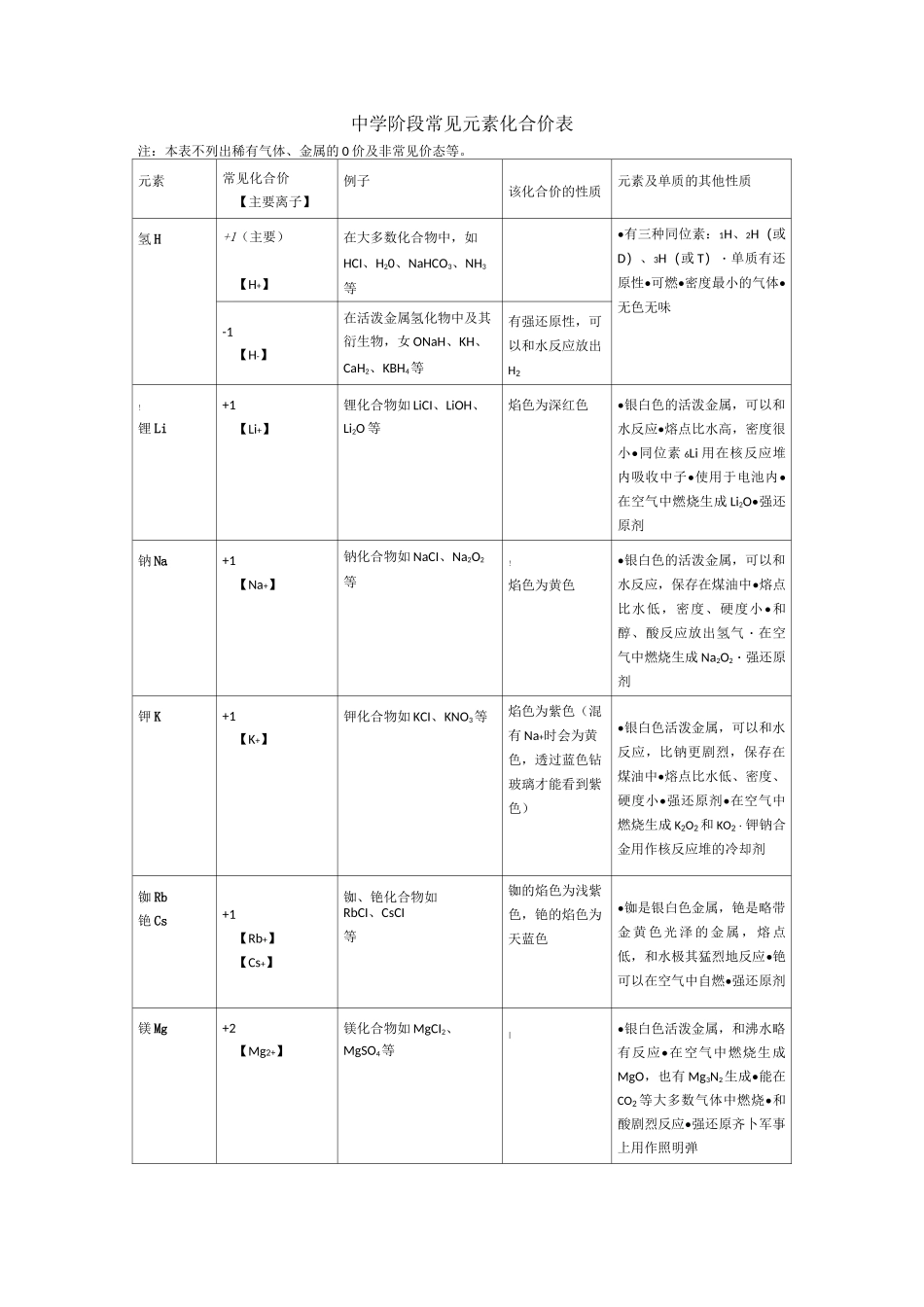
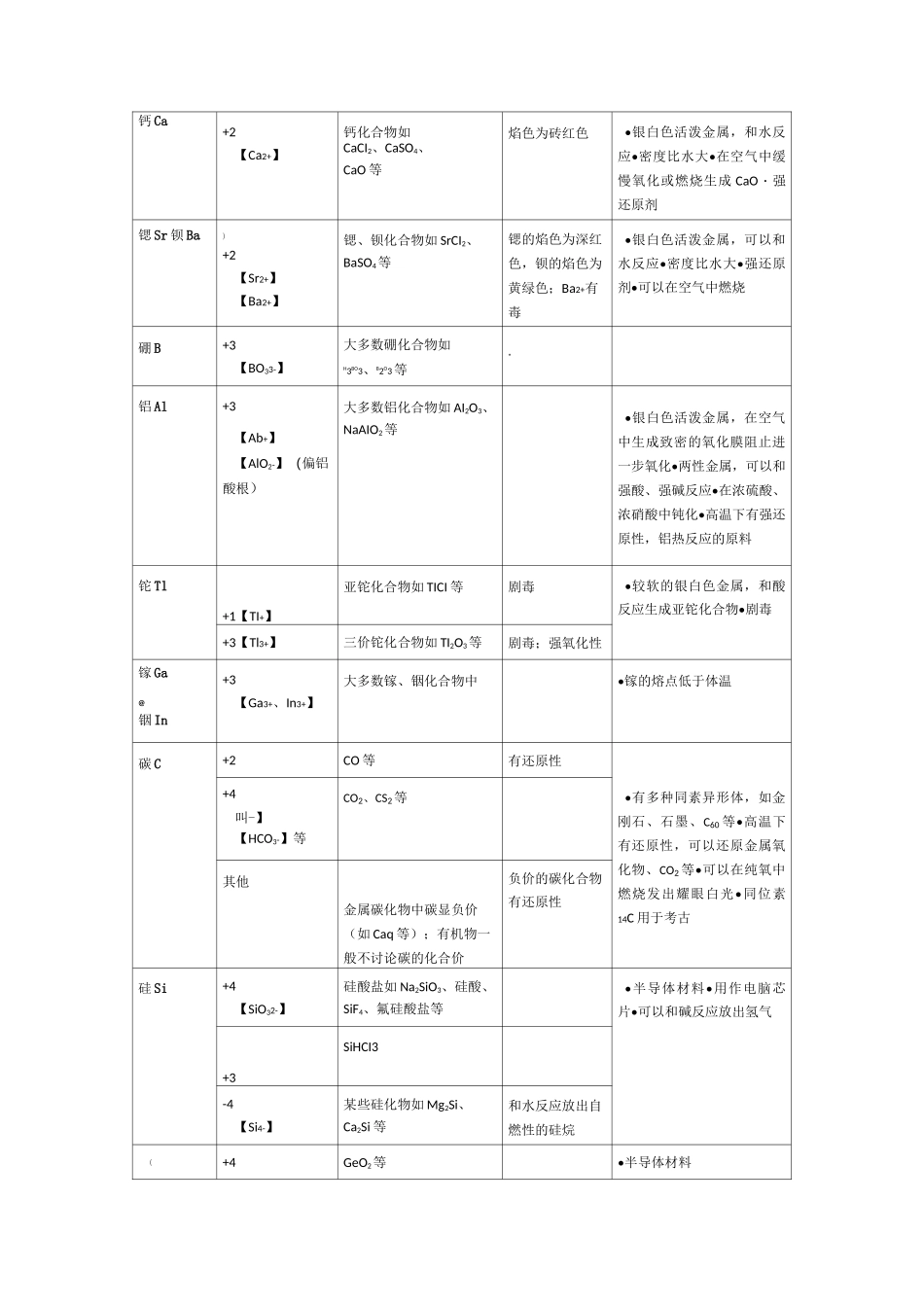
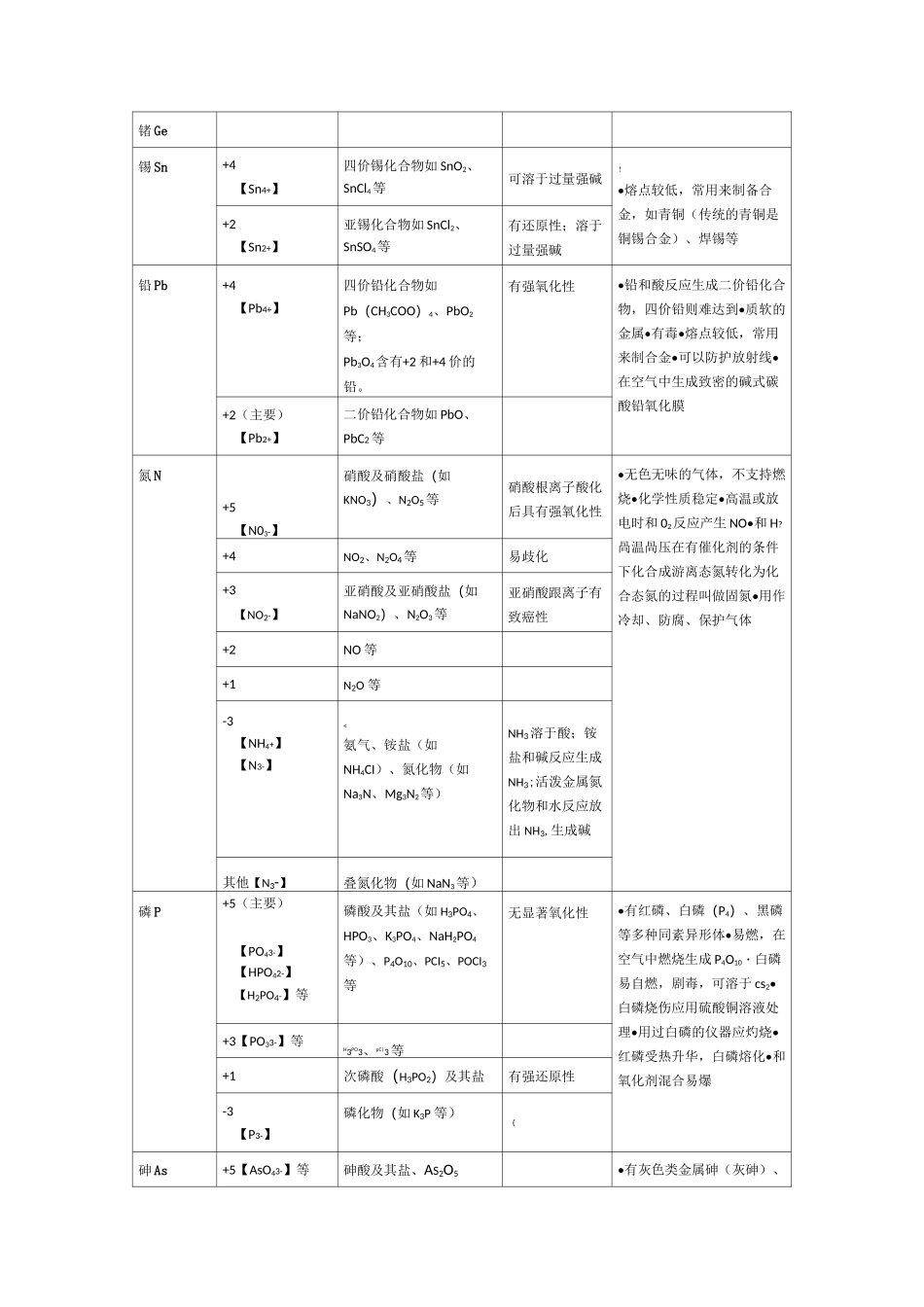
中学阶段常见元素化合价表注:本表不列出稀有气体、金属的0价及非常见价态等。元素常见化合价【主要离子】例子该化合价的性质元素及单质的其他性质氢H+1(主要)【H+】在大多数化合物中,如HCI、H20、NaHCO3、NH3等•有三种同位素:1H、2H(或D)、3H(或T)・单质有还原性•可燃•密度最小的气体•无色无味-1【H-】在活泼金属氢化物中及其衍生物,女ONaH、KH、CaH2、KBH4等有强还原性,可以和水反应放出H2!锂Li+1【Li+】锂化合物如LiCI、LiOH、Li2O等焰色为深红色•银白色的活泼金属,可以和水反应•熔点比水高,密度很小•同位素6Li用在核反应堆内吸收中子•使用于电池内•在空气中燃烧生成Li2O•强还原剂钠Na+1【Na+】钠化合物如NaCI、Na2O2等!焰色为黄色•银白色的活泼金属,可以和水反应,保存在煤油中•熔点比水低,密度、硬度小•和醇、酸反应放出氢气・在空气中燃烧生成Na2O2・强还原剂钾K+1【K+】钾化合物如KCI、KNO3等焰色为紫色(混有Na+时会为黄色,透过蓝色钻玻璃才能看到紫色)•银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中•熔点比水低、密度、硬度小•强还原剂•在空气中燃烧生成K2O2和KO2・钾钠合金用作核反应堆的冷却剂铷Rb铯Cs+1【Rb+】【Cs+】铷、铯化合物如RbCI、CsCI等铷的焰色为浅紫色,铯的焰色为天蓝色•铷是银白色金属,铯是略带金黄色光泽的金属,熔点低,和水极其猛烈地反应•铯可以在空气中自燃•强还原剂镁Mg+2【Mg2+】镁化合物如MgCI2、MgSO4等|•银白色活泼金属,和沸水略有反应•在空气中燃烧生成MgO,也有Mg3N2生成•能在CO2等大多数气体中燃烧•和酸剧烈反应•强还原齐卜军事上用作照明弹钙Ca+2【Ca2+】钙化合物如CaCI2、CaSO4、CaO等焰色为砖红色•银白色活泼金属,和水反应•密度比水大•在空气中缓慢氧化或燃烧生成CaO・强还原剂锶Sr钡Ba)+2【Sr2+】【Ba2+】锶、钡化合物如SrCI2、BaSO4等锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒•银白色活泼金属,可以和水反应•密度比水大•强还原剂•可以在空气中燃烧硼B+3【BO33-】大多数硼化合物如H3BO3、B2O3等"铝Al+3【Ab+】【AlO2-】(偏铝酸根)大多数铝化合物如AI2O3、NaAIO2等•银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化•两性金属,可以和强酸、强碱反应•在浓硫酸、浓硝酸中钝化•高温下有强还原性,铝热反应的原料铊Tl+1【TI+】亚铊化合物如TICI等剧毒•较软的银白色金属,和酸反应生成亚铊化合物•剧毒+3【Tl3+】三价铊化合物如TI2O3等剧毒;强氧化性镓Ga@铟In+3【Ga3+、In3+】大多数镓、铟化合物中•镓的熔点低于体温碳C+2CO等有还原性•有多种同素异形体,如金刚石、石墨、C60等•高温下有还原性,可以还原金属氧化物、CO2等•可以在纯氧中燃烧发出耀眼白光•同位素14C用于考古+4叫-】【HCO3-】等CO2、CS2等其他金属碳化物中碳显负价(如Caq等);有机物一般不讨论碳的化合价负价的碳化合物有还原性硅Si+4【SiO32-】硅酸盐如Na2SiO3、硅酸、SiF4、氟硅酸盐等•半导体材料•用作电脑芯片•可以和碱反应放出氢气+3SiHCI3-4【Si4-】某些硅化物如Mg2Si、Ca2Si等和水反应放出自燃性的硅烷(+4GeO2等•半导体材料锗Ge锡Sn+4【Sn4+】四价锡化合物如SnO2、SnCl4等可溶于过量强碱!•熔点较低,常用来制备合金,如青铜(传统的青铜是铜锡合金)、焊锡等+2【Sn2+】亚锡化合物如SnCl2、SnSO4等有还原性;溶于过量强碱铅Pb+4【Pb4+】四价铅化合物如Pb(CH3COO)4、PbO2等;Pb3O4含有+2和+4价的铅。有强氧化性•铅和酸反应生成二价铅化合物,四价铅则难达到•质软的金属•有毒•熔点较低,常用来制合金•可以防护放射线•在空气中生成致密的碱式碳酸铅氧化膜+2(主要)【Pb2+】二价铅化合物如PbO、PbC2等氮N+5【N03-】硝酸及硝酸盐(如KNO3)、N2O5等硝酸根离子酸化后具有强氧化性•无色无味的气体,不支持燃烧•化学性质稳定•高温或放电时和02反应产生NO•和H?咼温咼压在有催化剂的条件下化合成游离态氮转化为化合态氮的过程叫做固氮•用作冷却、防腐、保护气体+4NO2、N2O4等易歧化+3【NO2-】亚硝酸及亚硝酸盐(如NaNO2)、N2O3等亚硝酸跟离子有致癌性+2NO等+1N2O等...