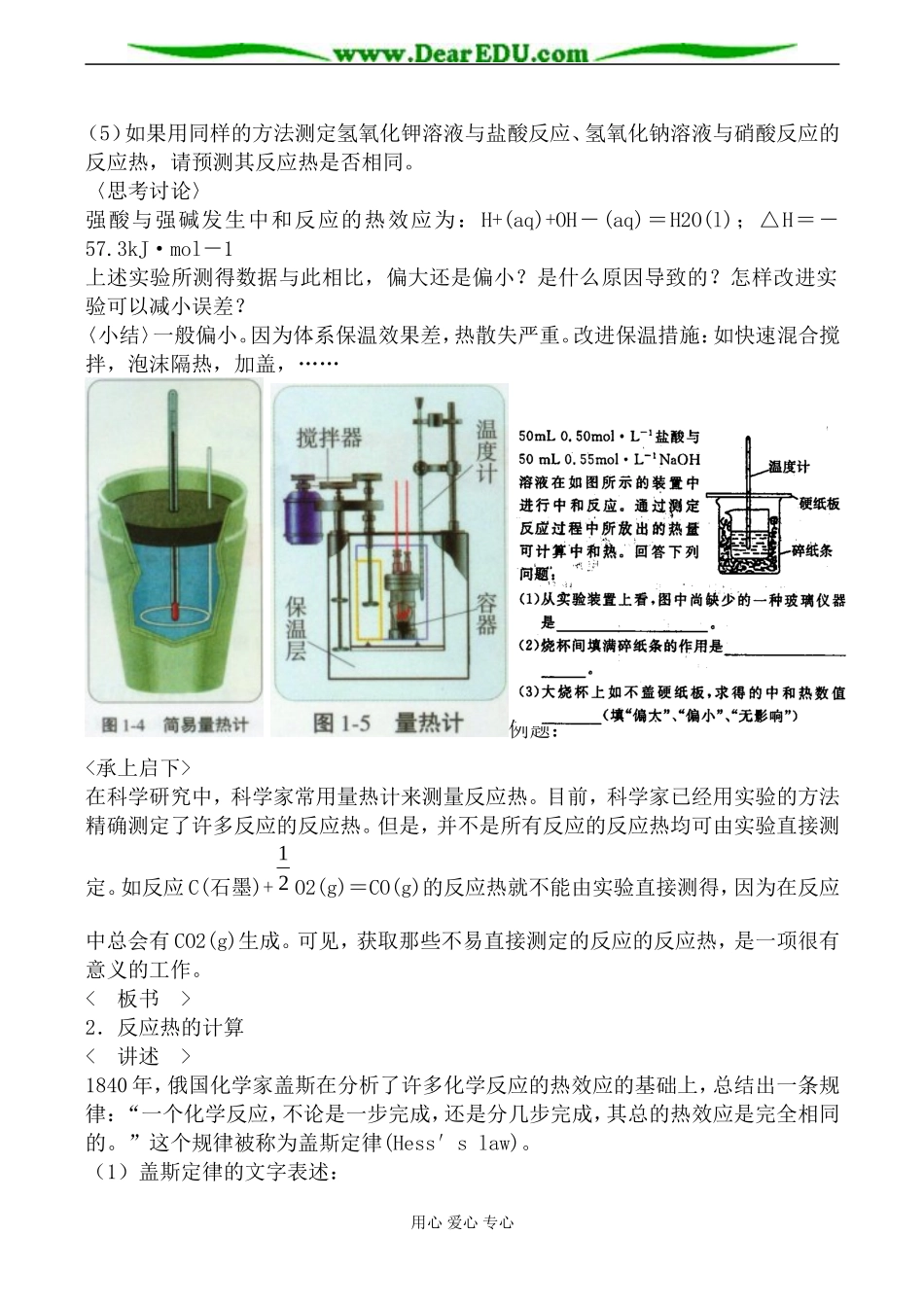
化学反应热的计算[教学目的]1.初步学习测定化学反应的反应热的实验方法,能正确分析误差产生的原因并能采取适当措施减小误差。2.知道盖斯定律的内容,能运用盖斯定律计算化学反应的反应热。[教学过程]<引入新课>不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,其中最直接的方法是通过实验进行测定。<板书>二、反应热的测量与计算1.反应热的测量<活动探究>请按照下列操作步骤用简易量热计测定盐酸与氢氧化钠溶液反应的反应热。(1)用量筒量取50mL0.50mol·L-1盐酸,倒入简易量热计中,测量并记录盐酸的温度(t1)。(2)用另一量筒量取50mL0.50mol·L-1氢氧化钠溶液,测量并记录氢氧化钠溶液的温度(t2)。(3)将量筒中的氢氧化钠溶液迅速倒入盛有盐酸的简易量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,观察温度计的温度变化,准确读出并记录反应体系的最高温度(t3)。(4)假设溶液的比热与水的比热相等,溶液的密度与水的密度相等,忽略量热计的比热,根据溶液温度升高的数值,计算中和反应的反应热并写出该反应的热化学方程式。实验记录表格设计123盐酸的温度(t1)/℃氢氧化钠溶液的温度((t2)/℃反应体系的最高温度(t3)/℃反应体系的温度变化(2213tttt)/℃反应体系的热容[18.4)(NaOHNaOHHClHClVVC]/J·℃-1中和反应的反应热(310025.0)(18.4tVVHNaOHNaOHHClHCl)/kJ·mol-1用心爱心专心(5)如果用同样的方法测定氢氧化钾溶液与盐酸反应、氢氧化钠溶液与硝酸反应的反应热,请预测其反应热是否相同。〈思考讨论〉强酸与强碱发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1上述实验所测得数据与此相比,偏大还是偏小?是什么原因导致的?怎样改进实验可以减小误差?〈小结〉一般偏小。因为体系保温效果差,热散失严重。改进保温措施:如快速混合搅拌,泡沫隔热,加盖,……例题:<承上启下>在科学研究中,科学家常用量热计来测量反应热。目前,科学家已经用实验的方法精确测定了许多反应的反应热。但是,并不是所有反应的反应热均可由实验直接测定。如反应C(石墨)+21O2(g)=CO(g)的反应热就不能由实验直接测得,因为在反应中总会有CO2(g)生成。可见,获取那些不易直接测定的反应的反应热,是一项很有意义的工作。<板书>2.反应热的计算<讲述>1840年,俄国化学家盖斯在分析了许多化学反应的热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律(Hess′slaw)。(1)盖斯定律的文字表述:用心爱心专心一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。(2)盖斯定律的实质:化学反应的焓变是能量守恒的具体体现,与状态有关,而与过程无关。可类比重力做功与位移有关,而与路程无关。<解决问题>已知在298K时,C(石墨)、CO(g)燃烧的热化学方程式如下:C(石墨)+O2(g)=CO2(g);△H1=-393.5kJ·mol-1①CO+21O2(g)=CO2(g);△H2=-283.0kJ·mol-1②请运用盖斯定律计算反应C(石墨)+21O2(g)=CO(g)③的焓变△H3。<解析>根据图示可分析得出:△H3=△H1-△H2=-393.5kJ·mol-1-(-283.0kJ·mol-1)=-110.5kJ·mol-1观察两个化学方程式:①-②C(石墨)+O2(g)=CO2(g)-CO+21O2(g)=CO2(g)得C(石墨)+21O2(g)=CO(g)即有:化学反应方程式可相加减,焓变也可相加减。(3)盖斯定律的数学表述:若一个反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而得到。若一个反应的焓变△H=akJ·mol-1,则其逆反应的焓变△H′=-akJ·mol-1例1.例2.用心爱心专心例3.课本P8(问题解决)(4)盖斯定律的意义:运用盖斯定律可以计算出反应速率慢、同时有副反应发生,不易直接进行的难以测定的化学反应的焓变。<小结>本节课我们学习了反应热的实验测定方法和数据处理的方法,以及应用盖斯定律计算难以测定的化学反应的焓变。看到理解盖斯定律可以用不同的方法,如化学的方法——质量守恒,能量守恒...