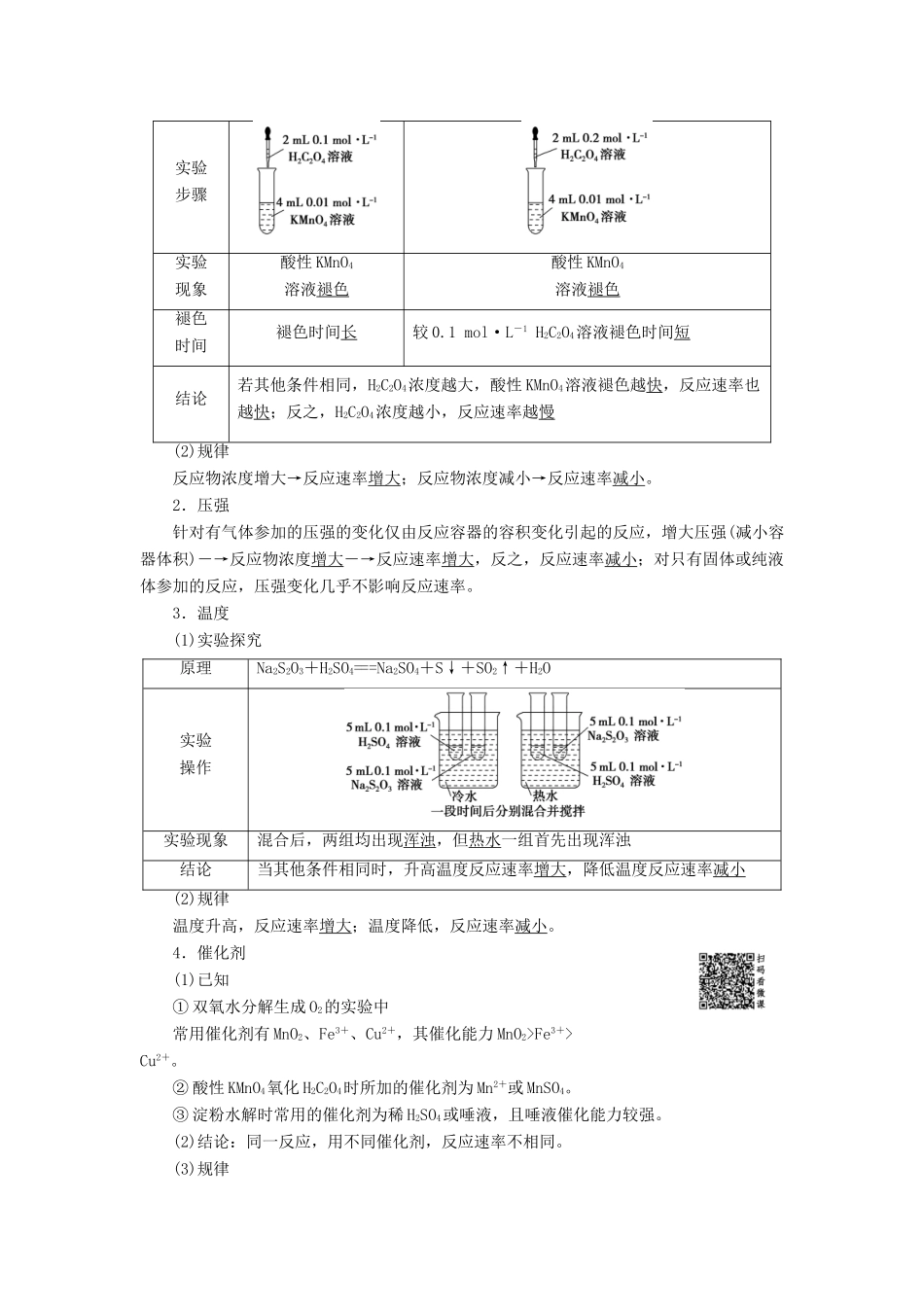
第二节影响化学反应速率的因素目标与素养:1.理解外界条件(温度、浓度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。(宏观辨识与科学探究)2.知道活化能的含义及其对化学反应速率的影响(宏观辨识与科学探究)3.了解催化剂在生产、生活和科学研究领域中的重大作用。(科学态度与社会责任)4.认识化学反应速率的调控在生活、生产和科学研究领域中的重要作用。(科学态度与社会责任)一、有效碰撞理论简介1.有效碰撞2.活化分子与活化能活化能越小,普通分子就越容易变成活化分子。如图所示:反应的活化能是E1,反应热是E1-E2。3.化学反应速率与活化分子、有效碰撞的关系活化分子的百分数越大,单位体积内活化分子数越多,单位时间内有效碰撞次数越多,化学反应速率越快。举例说明实现向体系提供活化能的方法有哪些?[答案]加热、光照、超声波、核辐射、研磨等。二、外界因素对化学反应速率的影响1.浓度(1)实验探究原理2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O实验步骤实验现象酸性KMnO4溶液褪色酸性KMnO4溶液褪色褪色时间褪色时间长较0.1mol·L-1H2C2O4溶液褪色时间短结论若其他条件相同,H2C2O4浓度越大,酸性KMnO4溶液褪色越快,反应速率也越快;反之,H2C2O4浓度越小,反应速率越慢(2)规律反应物浓度增大→反应速率增大;反应物浓度减小→反应速率减小。2.压强针对有气体参加的压强的变化仅由反应容器的容积变化引起的反应,增大压强(减小容器体积)―→反应物浓度增大―→反应速率增大,反之,反应速率减小;对只有固体或纯液体参加的反应,压强变化几乎不影响反应速率。3.温度(1)实验探究原理Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O实验操作实验现象混合后,两组均出现浑浊,但热水一组首先出现浑浊结论当其他条件相同时,升高温度反应速率增大,降低温度反应速率减小(2)规律温度升高,反应速率增大;温度降低,反应速率减小。4.催化剂(1)已知①双氧水分解生成O2的实验中常用催化剂有MnO2、Fe3+、Cu2+,其催化能力MnO2>Fe3+>Cu2+。②酸性KMnO4氧化H2C2O4时所加的催化剂为Mn2+或MnSO4。③淀粉水解时常用的催化剂为稀H2SO4或唾液,且唾液催化能力较强。(2)结论:同一反应,用不同催化剂,反应速率不相同。(3)规律①选用合适的催化剂,能使反应速率增大。②反应物之间同时发生多个反应时,催化剂有选择性,可以提高目标产物的比率。5.其他因素对化学反应速率的影响如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨、增大反应物接触面积等,均会对化学反应速率产生影响。1.判断正误(正确的打“√”,错误的打“×”)(1)Na、Mg、Al与同浓度的稀H2SO4反应,反应速率相同。()(2)升高温度,加压均可增大任何反应的化学反应速率。()(3)锌与稀H2SO4反应时,硫酸的浓度越大,产生H2的速率越快。()(4)催化剂可以加快反应也可以改变反应热。()[答案](1)×(2)×(3)×(4)×2.有效碰撞是指()A.反应物分子间的碰撞B.反应物活化分子间的碰撞C.反应物分子发生合适取向的碰撞D.活化分子之间发生合适取向的碰撞[答案]D3.在一密闭容器中充入1molI2和1molH2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)(1)保持容器容积不变,向其中充入1molH2,反应速率________。(2)升高温度,反应速率________。(3)扩大容器体积,反应速率________。[答案](1)增大(2)增大(3)减小影响反应速率的外界条件1.外界条件对反应速率的影响影响因素影响结果(其他条件不变)浓度固体或纯液体浓度为常数,增加反应物的量,反应速率不变(固体物质的表面积影响反应速率)气体或溶液增大反应物的浓度,反应速率加快升高温度反应速率加快增大压强(缩小体积)对于气体,反应速率加快;对于非气体物质,影响不大使用正催化剂反应速率加快2.理论解释——有效碰撞理论注意:①活化分子数变,反应速率不一定变;但活化分子百分数变,则反应速率一定变。②对于可逆反应,升温、加压,加入催化剂既加快正反应速率又加快逆反应速率。科学探究:压强对反应速率影响的探究分析对有气体参加的反应,压强对化学反应速率的影响可简化理解如下:压强改变→常见的形式有以下几种...