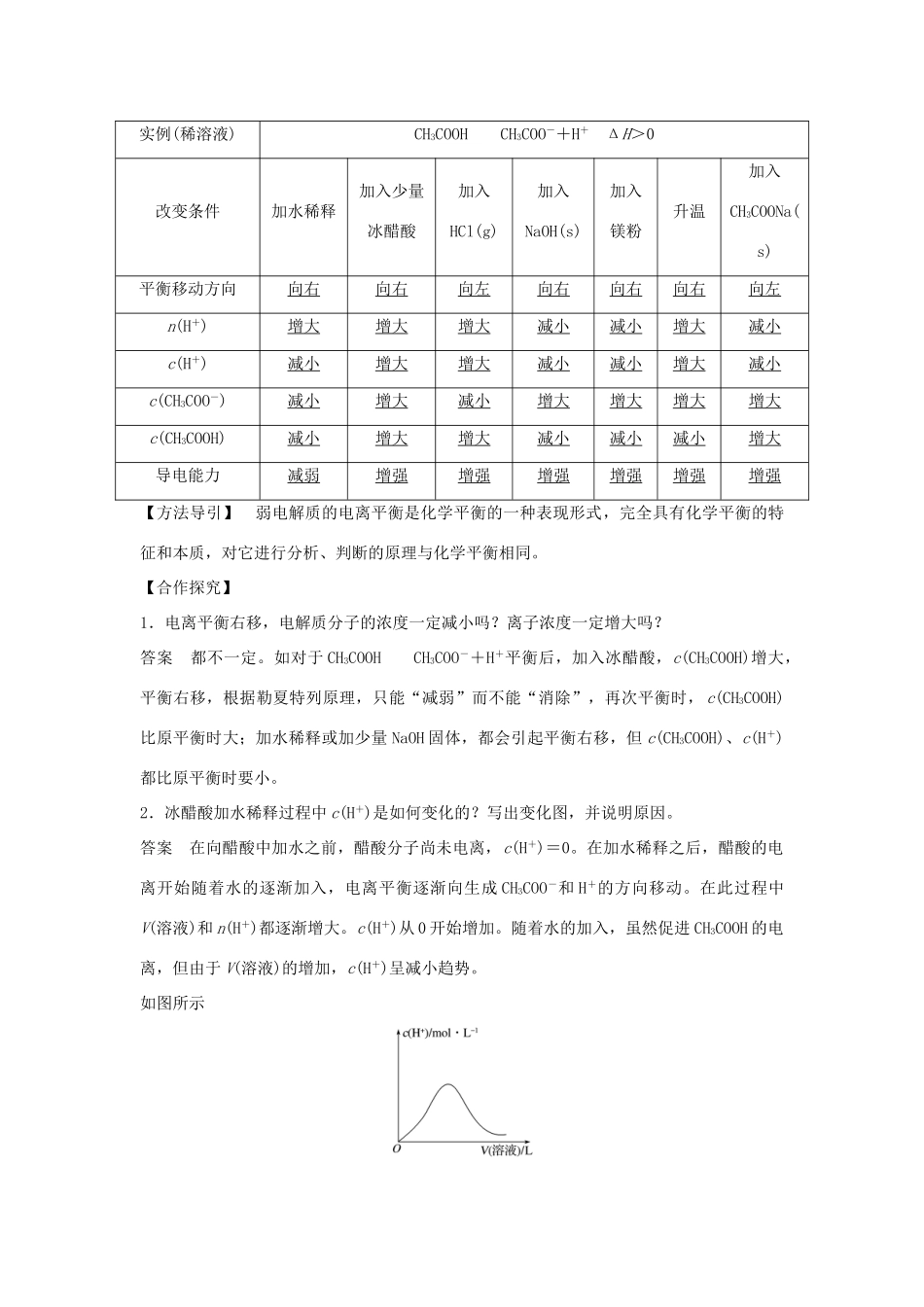
第2课时弱电解质的电离平衡[目标导航]1.理解电离平衡的概念。2.了解电离度的概念及其简单的计算。3.能运用电离平衡原理解释弱电解质在水溶液中的电离情况。一、弱电解质的电离平衡1.定义在一定条件下(如温度和浓度),电解质电离成离子的速率和离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程达到电离平衡状态。2.建立过程(用vt图像描述)3.特征4.外界条件对电离平衡的影响①内因:弱电解质本身的性质。②外因:浓度、温度、加入试剂等。5.电离过程是可逆过程,可直接用化学平衡移动原理分析电离平衡。以0.1mol·L-1CH3COOH溶液为例:CH3COOHCH3COO-+H+(正向吸热)。实例(稀溶液)CH3COOHCH3COO-+H+ΔH>0改变条件加水稀释加入少量冰醋酸加入HCl(g)加入NaOH(s)加入镁粉升温加入CH3COONa(s)平衡移动方向向右向右向左向右向右向右向左n(H+)增大增大增大减小减小增大减小c(H+)减小增大增大减小减小增大减小c(CH3COO-)减小增大减小增大增大增大增大c(CH3COOH)减小增大增大减小减小减小增大导电能力减弱增强增强增强增强增强增强【方法导引】弱电解质的电离平衡是化学平衡的一种表现形式,完全具有化学平衡的特征和本质,对它进行分析、判断的原理与化学平衡相同。【合作探究】1.电离平衡右移,电解质分子的浓度一定减小吗?离子浓度一定增大吗?答案都不一定。如对于CH3COOHCH3COO-+H+平衡后,加入冰醋酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理,只能“减弱”而不能“消除”,再次平衡时,c(CH3COOH)比原平衡时大;加水稀释或加少量NaOH固体,都会引起平衡右移,但c(CH3COOH)、c(H+)都比原平衡时要小。2.冰醋酸加水稀释过程中c(H+)是如何变化的?写出变化图,并说明原因。答案在向醋酸中加水之前,醋酸分子尚未电离,c(H+)=0。在加水稀释之后,醋酸的电离开始随着水的逐渐加入,电离平衡逐渐向生成CH3COO-和H+的方向移动。在此过程中V(溶液)和n(H+)都逐渐增大。c(H+)从0开始增加。随着水的加入,虽然促进CH3COOH的电离,但由于V(溶液)的增加,c(H+)呈减小趋势。如图所示二、电离平衡常数(K)、电离度(α)1.电离常数(1)表示方法ABA++B-K=弱电解质的电离常数表达式中的c(A+)、c(B-)和c(AB)均为达到电离平衡后各粒子在溶液中的浓度值,并不是直接指溶质的物质的量浓度值,并且在温度一定时,其电离常数就是一个定值。①一元弱酸、一元弱碱的电离常数。例如:CH3COOHCH3COO-+H+Ka=NH3·H2ONH+OH-Kb=②多元弱酸、多元弱碱的电离常数。多元弱酸的电离是分步进行的,每步都有相应的电离常数,通常用Ka1,Ka2,Ka3等来分别表示。例如:H3PO4H++H2POKa1=H2POH++HPOKa2=HPOH++POKa3=多元弱酸各步的电离常数大小的比较为Ka1≫Ka2≫Ka3,因此多元弱酸的酸性主要由第一步电离决定。多元弱碱的电离与多元弱酸的电离情况相类似,但多元弱碱的电离可写成一步。(2)影响因素电离常数只与温度有关,升高温度,K值增大。(3)电离常数的意义①表示多元弱酸溶液中离子浓度的关系。H3PO4分三步电离,第一步最强(Ka1=7.5×10-3),第二步弱(Ka2=6.2×10-8),第三步最弱(Ka3=2.2×10-13),c(H+)>c(H2PO)>c(HPO)>c(PO)>c(OH-)。H2S分两步电离,第一步强(Ka1=9.1×10-8),第二步弱(Ka2=1.1×10-12),c(H+)>c(HS-)>c(S2-)>c(OH-)②根据电离常数的大小,可以估算弱电解质电离的程度。例如,在相同条件下,K值越大,弱酸的电离程度越大,酸性越强。在相同条件下,常见弱酸的酸性强弱关系为H3PO4>HF>CH3COOH>H2CO3>H2S>HClO。2.电离度(1)弱电解质的电离度用α表示则α=×100%,或α=×100%,或α=×100%。(2)影响电离度的因素①温度升高温度,电离平衡向正反应方向移动,电离度增大。②浓度加水稀释,电离平衡向正反应方向移动,电离度增大。即浓度越大,电离度越小,浓度越小,电离度越大。(3)意义①电离度实质上是一种平衡转化率。表示弱电解质在水中的电离程度。②温度相同,浓度也相同时,不同弱电解质的电离度是不同的。【合作探究】1.H2CO3的...