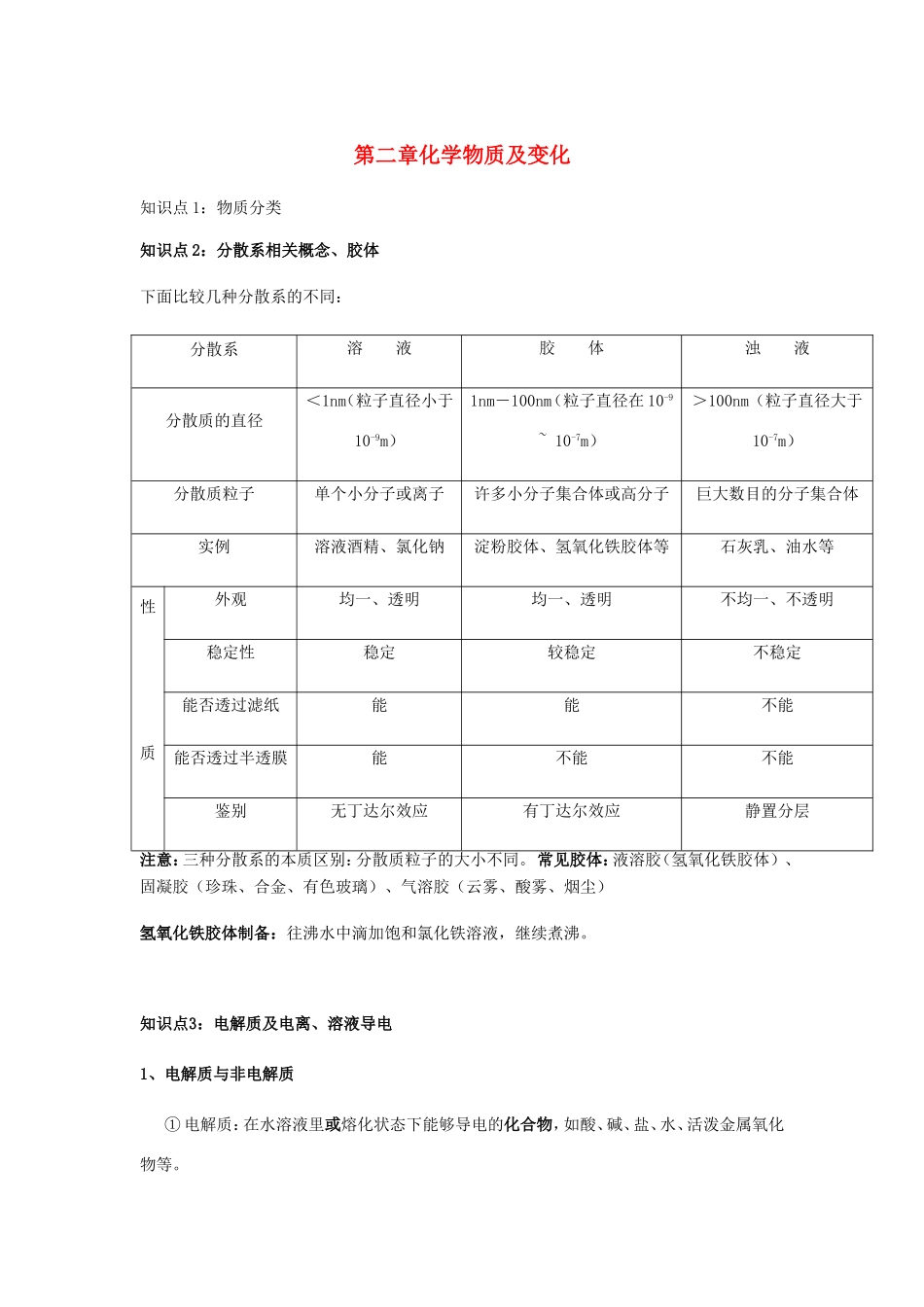
第二章化学物质及变化知识点1:物质分类知识点2:分散系相关概念、胶体下面比较几种分散系的不同:分散系溶液胶体浊液分散质的直径<1nm(粒子直径小于10-9m)1nm-100nm(粒子直径在10-9~10-7m)>100nm(粒子直径大于10-7m)分散质粒子单个小分子或离子许多小分子集合体或高分子巨大数目的分子集合体实例溶液酒精、氯化钠淀粉胶体、氢氧化铁胶体等石灰乳、油水等性质外观均一、透明均一、透明不均一、不透明稳定性稳定较稳定不稳定能否透过滤纸能能不能能否透过半透膜能不能不能鉴别无丁达尔效应有丁达尔效应静置分层注意:三种分散系的本质区别:分散质粒子的大小不同。常见胶体:液溶胶(氢氧化铁胶体)、固凝胶(珍珠、合金、有色玻璃)、气溶胶(云雾、酸雾、烟尘)氢氧化铁胶体制备:往沸水中滴加饱和氯化铁溶液,继续煮沸。知识点3:电解质及电离、溶液导电1、电解质与非电解质①电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐、水、活泼金属氧化物等。②非电解质:在水溶液里和熔融状态下都不导电的化合物,如蔗糖、酒精等。注意:(1)能导电的物质不一定全是电解质,必须是化合物。如Cu等金属可导电但属于单质,K2SO4与NaCl溶液等可导电但属于混合物。电解质本身不一定能导电,如NaCl晶体。(2)电解质不是在任何条件才都导电。如酸(盐酸、硝酸、硫酸、醋酸等)和NH3·H2O须在水溶液中才导电,难溶的碱和盐如BaSO4、AgCl,其水溶液导电性差,需在熔融状态导电。含金属离子或NH4+构成的可溶于水的离子型化合物,在熔融状态以及在水溶液都能导电,如氯化钠,其水溶液和熔融氯化钠都能导电。)(3)溶于水和熔化状态两各条件只需满足其中之一,溶于水不是指和水反应。例如CO2溶于水能导电是因CO2与H2O反应生成了H2CO3,H2CO3是电解质,CO2却属于非电解质。【针对练习1】下列物质能导电的是属于电解质的是,属于非电解质的是。①水银②烧碱③大理石④氯化钠晶体⑤盐酸⑥氨气⑦蔗糖⑧氯气⑨液态氯化氢⑩硫酸溶液2、电离及电离方程式电离:电解质溶于水或受热熔化时解离成自由离子的过程。酸:电离时生成的阳离子全部都是氢离子的化合物。H2SO4=2H++SO42-、HCl=H++Cl-。碱:电离时生成的阴离子全部都是氢氧根离子的化合物。盐:电离时生成的金属阳离子(或NH4+)和酸根阴离子的化合物。电离出金属阳离子外还能电离产生H+的盐叫酸式盐,如NaHSO4、NaHCO3。注意:1、HCO3-、OH-、SO42-等原子团不能拆开;2、HSO4―在水溶液中拆开写,熔融状态不拆开写。【针对练习2】书写下列物质的电离方程式:AgNO3、BaCl2、NaHSO4、NaHCO3AgNO3BaCl2NaHSO4NaHCO3知识点4:离子方程式书写1、书写步骤:第一步:写(基础),写出正确的化学方程式。例如:CuSO4+BaCl2=BaSO4↓+CuCl2第二步:拆(关键),把易溶、易电离的物质拆成离子形式(难溶、难电离的以及气体等仍用化学式表示)Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-第三步:删(途径),删去两边不参加反应的离子。Ba2++SO42-=BaSO4↓第四步:查(保证),检查(质量守恒、电荷守恒)。Ba2++SO42-=BaSO4↓质量守恒:左右原子数相等;电荷守恒:左电荷:2+(—2)=0,右电荷:0注意:易溶易电离物质(强酸、强碱和可溶于水的盐)能拆写;非电解质、弱电解质、难溶于水的物质、氧化物、气体等在反应物、生成物中出现,均写成化学式或分式。如HAc+OH-=Ac-+H2O。固体间的反应,即使是电解质,也写成化学式或分子式。【针对练习3】(1)写出下列反应对应的离子方程式①往烧碱溶液中通入二氧化碳的反应____________________________________②H2SO4溶液与Ba(OH)2溶液的反应③盐酸与碳酸钙的反应______________________________________④碳酸氢钠溶液与盐酸反应_;(2)写出与下列离子方程式相对应的化学方程式⑤Cu2++Fe=Fe2++Cu____________________________________⑥CO32—+2H+==CO2↑+H2O:。2、判断离子方程式书写是否正确。(完成下列判断,错的找出错因,写出正确答案)一看书写:是否符合反应事实(1)钠投入CuSO4溶液中:2Na+Cu2+=2Na++Cu()(2)铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑()...