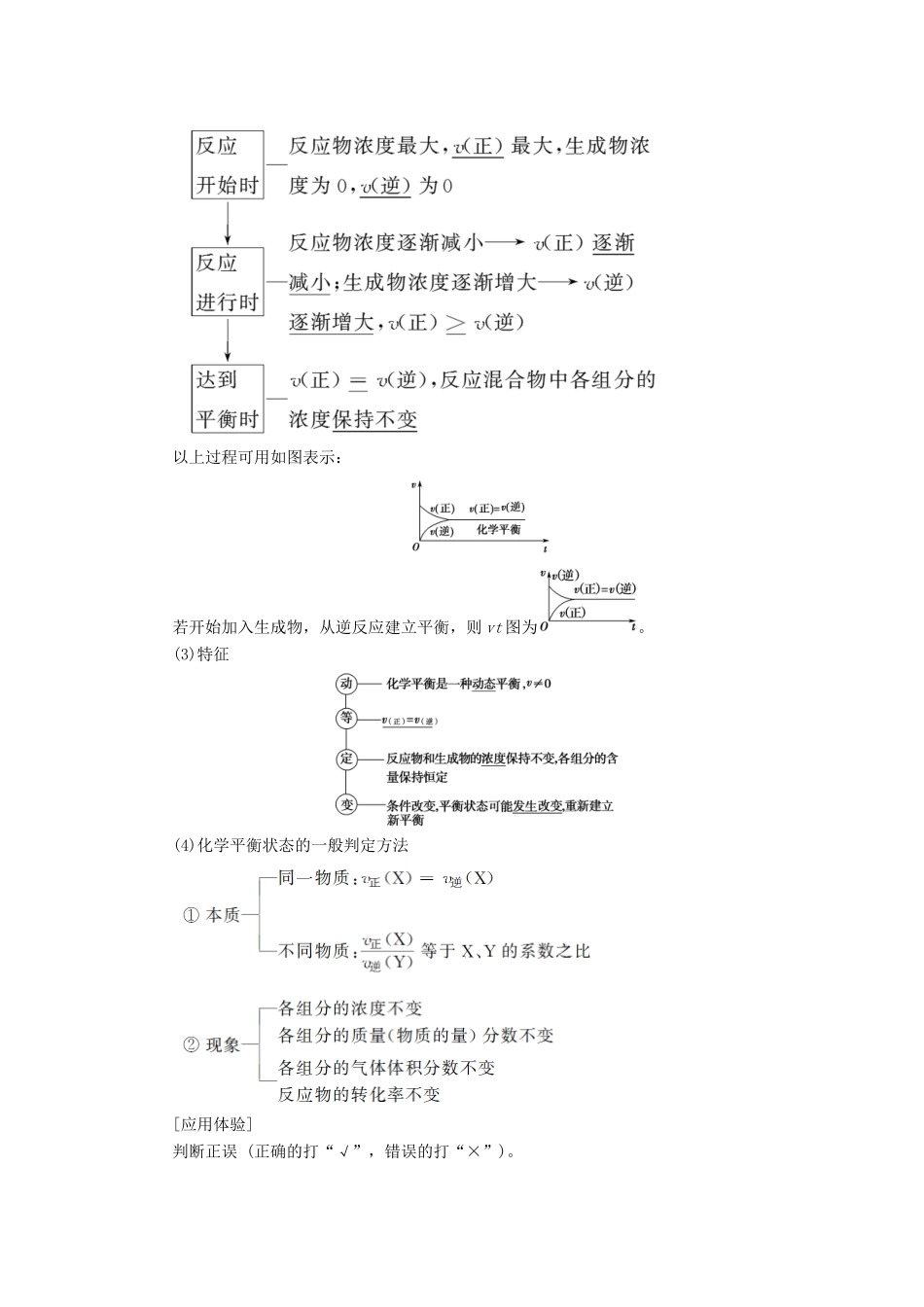
第2节化学平衡状态和平衡移动考纲定位全国卷5年考情1.了解化学反应的可逆性及化学平衡的建立。2.掌握化学平衡的特征。3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。4.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。2017年:Ⅰ卷T28(2、3);Ⅱ卷T27;Ⅲ卷T28(4)2016年:Ⅰ卷T27(1)(2);Ⅱ卷T27;Ⅲ卷T27(2、3)2015年:Ⅰ卷T28(4);Ⅱ卷T27(2、3)2014年:Ⅰ卷T28(3);Ⅱ卷T26(2、3)2013年:Ⅰ卷T28(2、3、4);Ⅱ卷T28(1)考点1|可逆反应与化学平衡状态(对应学生用书第135页)[考纲知识整合]1.可逆反应示例:向含有2mol的SO2的容器中通入过量氧气发生2SO2(g)+O2(g)2SO3(g)ΔH=-QkJ·mol-1(Q>0),充分反应后生成SO3的物质的量________2mol(填“<”“>”或“=”,下同),SO2的物质的量________0mol,转化率________100%,反应放出的热量________QkJ。【提示】<><<2.化学平衡状态(1)概念一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态。(2)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:以上过程可用如图表示:若开始加入生成物,从逆反应建立平衡,则vt图为。(3)特征(4)化学平衡状态的一般判定方法[应用体验]判断正误(正确的打“√”,错误的打“×”)。(1)2H2O2H2↑+O2↑为可逆反应。()(2)在一定条件下,向密闭容器中充入1molN2和3molH2充分反应,生成2molNH3。()(3)在化学平衡的建立过程中v正一定大于v逆。()(4)对于NO2(g)+SO2(g)SO3(g)+NO(g)反应,当每消耗1molSO3的同时生成1molNO2时,说明反应达到平衡状态。()(5)对于A(g)+B(g)2C(g)+D(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志。()(6)化学平衡建立过程中,反应物浓度减小而生成物浓度增大,当二者相等时,反应达到平衡状态。()【答案】(1)×(2)×(3)×(4)×(5)×(6)×[高考命题点突破]命题点1极端转化法确定可逆反应某状态的量1.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()【导学号:95160201】A.Z为0.3mol·L-1B.Y2为0.4mol·L-1C.X2为0.2mol·L-1D.Z为0.4mol·L-1A[假设反应正向进行到底:X2(g)+Y2(g)2Z(g)起始浓度/(mol·L-1)0.10.30.2改变浓度/(mol·L-1)0.10.10.2终态浓度/(mol·L-1)00.20.4假设反应逆向进行到底:X2(g)+Y2(g)2Z(g)起始浓度/(mol·L-1)0.10.30.2改变浓度/(mol·L-1)0.10.10.2终态浓度/(mol·L-1)0.20.40平衡体系中各物质的浓度范围为0