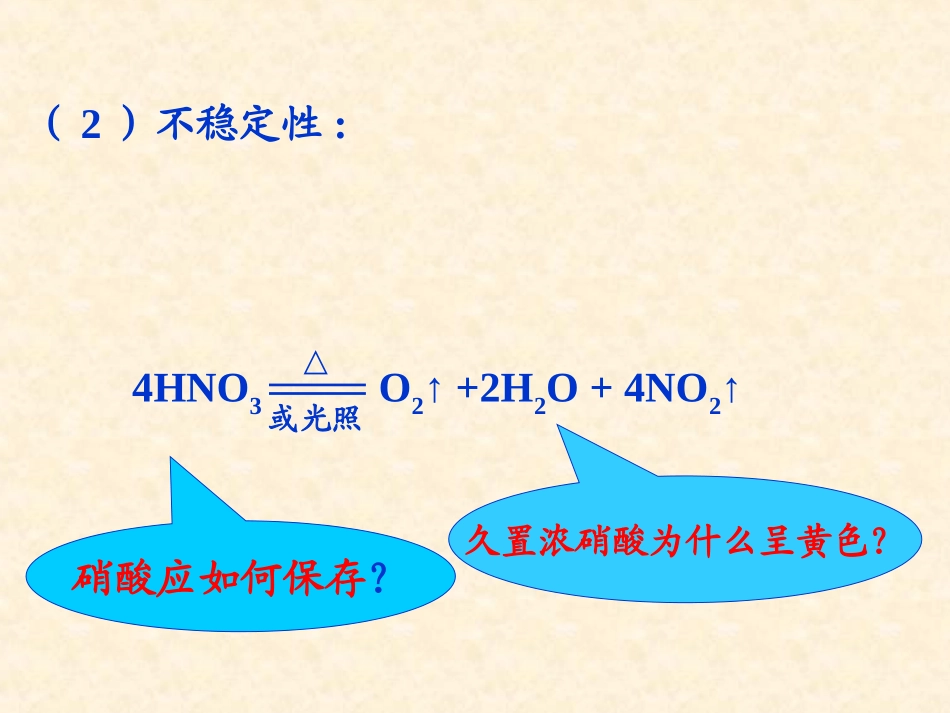
三、硝酸的性质11。物理性质。物理性质(1)纯HNO3是色、易,有气味的液体.挥发刺激性无(2)能与水任意比互溶.常用浓硝酸质量分数为69%。质量分数为98%以上的硝酸为“发烟硝酸”。(3)纯HNO3的沸点是83℃,密度为1.5027g/cm3,22。化学性质。化学性质(1)酸的通性:1.使紫色的石蕊试液变红;2.与金属反应,但不产生氢气;3.与某些金属氧化物起反应;2HNO3+CuO=Cu(NO3)2+H2O4.与碱起反应HNO3+NaOH=NaNO3+H2O5.与某些盐起反应2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O(2)不稳定性:4HNO3O2↑+2H2O+4NO2↑△或光照硝酸应如何保存?久置浓硝酸为什么呈黄色?4HNO3O2↑+2H2O+4NO2↑△或光照久置硝酸分解产生的NO2溶于溶液中,使得溶液变黄!密封于棕色瓶中,并放在阴暗处!保存:(3)强氧化性:实验现象:实验结论:实验操作:溶液中有气泡产生,具支试管中充满红棕色气体,小试管中为无色气体。NO32HNOO2H23NOCu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(3)强氧化性:实验现象:实验结论:实验操作:溶液中有气泡产生,具支试管、小试管中气体均为无色。3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O【发散思维】【发散思维】•试推测常温下,浓硝酸、稀硝酸与不活泼金属银的反应方程式。Ag+2HNO3(浓)=AgNO3+NO2↑+H2O3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O(3)强氧化性:②②硝酸能与许多非金属反硝酸能与许多非金属反应应::C+4HNO3(浓)CO2↑+4NO2↑+2H2O③③硝酸能与许多还原性化合物反硝酸能与许多还原性化合物反应应::如如:SO:SO22、、NaNa22SOSO33、、KIKI、、FeClFeCl22等。等。硝酸与金属反应的规律硝酸与金属反应的规律::(2)金属与硝酸反应时金属被氧化成相应的高价硝酸盐:浓HNO3的还原产物一般是NO2,稀HNO3还原产物一般是NO。(1)Fe、Al、等金属和稀HNO3能反应,但在冷的浓HNO3中钝化。(3)硝酸浓度越高,氧化性越强。44。制取:。制取:(1)实验室:(2)工业上:NaNO3+H2SO4(浓)=NaHSO4+HNO3↑3OH2OO3HNONONONH22222NO2O2NOO6H4NO5O4NH223催化剂△NO32HNOO2H23NO随堂测试随堂测试1.硝酸应如何贮存?2.解释为什么实验室制H2可用稀盐酸或稀硫酸,而不能用稀的硝酸?答:应放于棕色瓶中,储存于阴暗处.答:因为硝酸不论浓稀都具有强氧化性。用金属与硝酸反应时,H+不能得到电子,只能是HNO3中的N得到电子,故不能得到氢气!课堂练习3.填空稀硝酸能使紫色石蕊试液变红热的浓硝酸使红热的碳燃烧久置的浓硝酸呈黄色事实化学方程式性质酸的通性不稳定性强氧化性4HNO32H2O+4NO2↑+O2↑△光照C+4HNO32H2O+4NO2↑(浓)+CO2↑△5.下列关于硝酸正确的是()A.稀硝酸能与Fe发生反应,浓硝酸不能B.浓硝酸和稀硝酸都是强氧化剂C.稀硝酸是弱酸,浓硝酸是强酸D.稀硝酸与Cu反应,生成NO2,而浓硝酸与Cu反应只生成NO,稀硝酸得电子更多,故稀硝酸氧化性大于浓硝酸课堂练习4.常温下能用铝制容器盛放的是()A.浓盐酸B.浓硝酸C.浓硫酸D.稀硝酸BCB