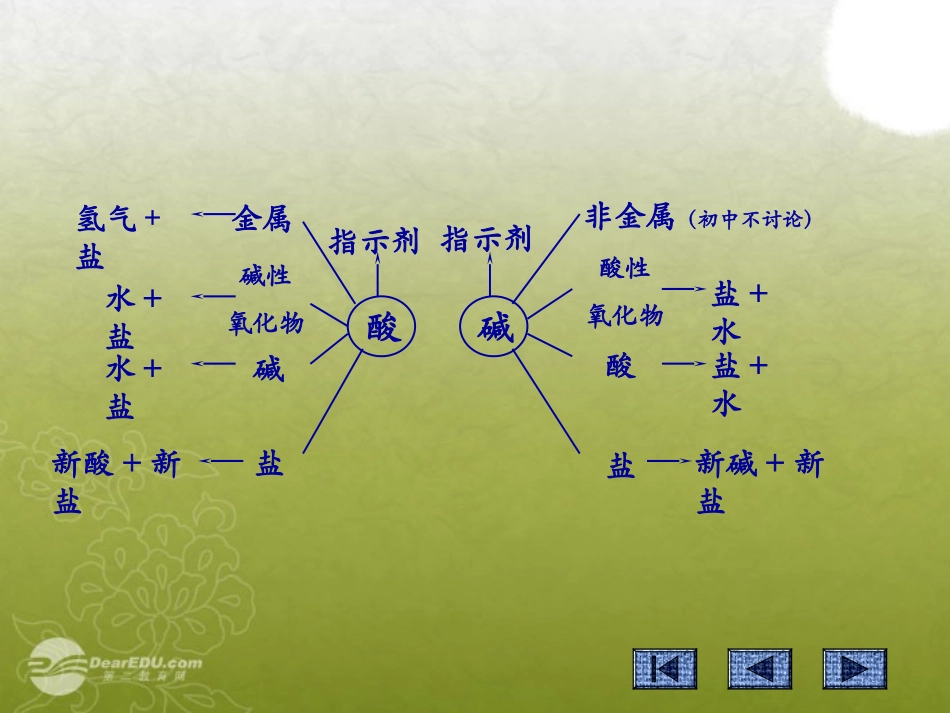
酸碱指示剂指示剂金属氢气+盐碱性氧化物水+盐碱水+盐盐新酸+新盐非金属(初中不讨论)酸性氧化物盐+水酸盐+水盐新碱+新盐一、盐的化学性质⒈盐+酸→新盐+新酸AgNO3+HCl==AgCl↓+HNO3BaCl2+H2SO4==BaSO4↓+2HClCaCO3+2HCl==CaCl2+H2O+CO2↑⒉盐+碱→新盐+新碱CuSO4+2NaOH==Na2SO4+Cu(OH)2↓FeCl3+3NaOH==3NaCl+Fe(OH)3↓Na2CO3+Ca(OH)2==CaCO3↓+2NaOHMg+2HCl==MgCl2+H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑Zn+H2SO4==ZnSO4+H2↑Fe+2HCl==FeCl2+H2↑★活泼金属+酸→盐+氢气KCaNaMgAlZnFeSnPbHCuAgPtAu金属活动性由强逐渐减弱金属盐溶液现象AlCuSO4铝条的表面_________________CuAgNO3铜丝的表面_________________CuZnSO4铜丝的表面_________________覆盖一层红色物质覆盖一层银白色物质没有变化3CuSO4+2Al==Al2(SO4)3+3Cu2AgNO3+Cu==Cu(NO3)2+2AgZnSO4+Cu≠不反应KCaNaMgAlZnFeSnPbHCuAgPtAu金属活动性由强逐渐减弱3CuSO4+2Al==Al2(SO4)3+3Cu2AgNO3+Cu==Cu(NO3)2+2Ag⒊盐+金属→新盐+新金属⒊盐+金属→新盐+新金属结论:在金属活动顺序中,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液里置换出来。★不用K、Ca、Na去置换盐溶液的金属盐+盐→两种新盐?盐溶液盐溶液现象NaClAgNO3溶液中____________Na2SO4BaCl2溶液中____________生成白色沉淀生成白色沉淀AgNO3+NaCl==AgCl↓+NaNO3BaCl2+Na2SO4==BaSO4↓+2NaCl⒊盐+盐→两种新盐盐金属酸碱盐盐+金属盐+酸盐+碱盐+盐Na2CO3+2HCl==2NaCl+H2O+CO2↑AgNO3+HCl==AgCl↓+HNO3Zn+H2SO4==ZnSO4+H2↑ZnO+H2SO4==ZnSO4+H2OZn(OH)2+H2SO4==ZnSO4+2H2OZnCO3+H2SO4==ZnSO4+H2O+CO2↑Zn+FeSO4==ZnSO4+Fe讨论:举出四种制备硫酸锌的方法◆◆◆由两种化合物相互交换成分,生成另外两种化合物的反应。复分解反应:盐+酸盐+碱盐+盐酸+碱盐+酸→新盐+新酸AgNO3+HCl==AgCl+HNO3BaCl2+H2SO4==BaSO4+2HClCaCO3+2HCl==CaCl2++CO2盐+碱→新盐+新碱CuSO4+2NaOH==Na2SO4+Cu(OH)2FeCl3+3NaOH==3NaCl+Fe(OH)3Na2CO3+Ca(OH)2==CaCO3+2NaOH盐+盐→两种新盐AgNO3+NaCl==AgCl+NaNO3BaCl2+Na2SO4==BaSO4+2NaCl酸+碱→盐+水2HCl+Ca(OH)2==CaCl2+2H2SO4+2NaOH==Na2SO4+↓↓↓↓↓↓↓H2O↑H2OH2ONaCl+KNO3→?二、复分解反应发生的条件反应物:均可溶于水(包括溶于酸)生成物:沉淀、气体或水复分解反应口诀复分解,两头顾;先顾头,后顾尾;顾头要看溶解性,盐碱、盐盐均可溶;可以反应再顾尾,产生气体、沉淀、水;交换离子写反应,气体沉淀标符号。酸、碱、盐的溶解性口诀钾钠铵盐硝酸盐,溶入水中都不见;硫酸钡、氯化银,白色沉淀现象明;碳酸钾钠铵能溶,碳酸铝铁影无踪;要问碱类溶多少,钾钠钡钙铵中找。下列几组物质能否在水溶液里发生反应,若不反应说明理由⑴Zn+Pb(NO3)2⑵Cu+Hg(NO3)2⑶Cu+FeCl2⑷3AgNO3+FeCl3⑸BaCl2+(NH4)2SO4⑹AgCl+NaNO3⑺Ca(OH)2+Na2CO3⑻Na2SO4+HCl⑼Ag2CO3+2HCl⑽Cu+HCl==Pb+Zn(NO3)2==Hg+Cu(NO3)2≠不反应==3AgCl↓+Fe(NO3)3==BaSO4↓+2NH4Cl≠不反应==CaCO3↓+2NaOH≠不反应==AgCl↓+H2O+CO2↑≠不反应各举一例酸、碱、盐,写出它们之间相互反应的化学方程式。如:H2SO4NaOHBaCl2H2SO4+2NaOH==Na2SO4+2H2OH2SO4+BaCl2==BaSO4↓+2HCl★盐的性质金属→新金属+新盐酸→新盐+新酸盐+碱→新盐+新碱盐→两种新盐★复分解反应发生的条件反应物:均可溶于水(包括溶于酸)生成物:沉淀、气体或水