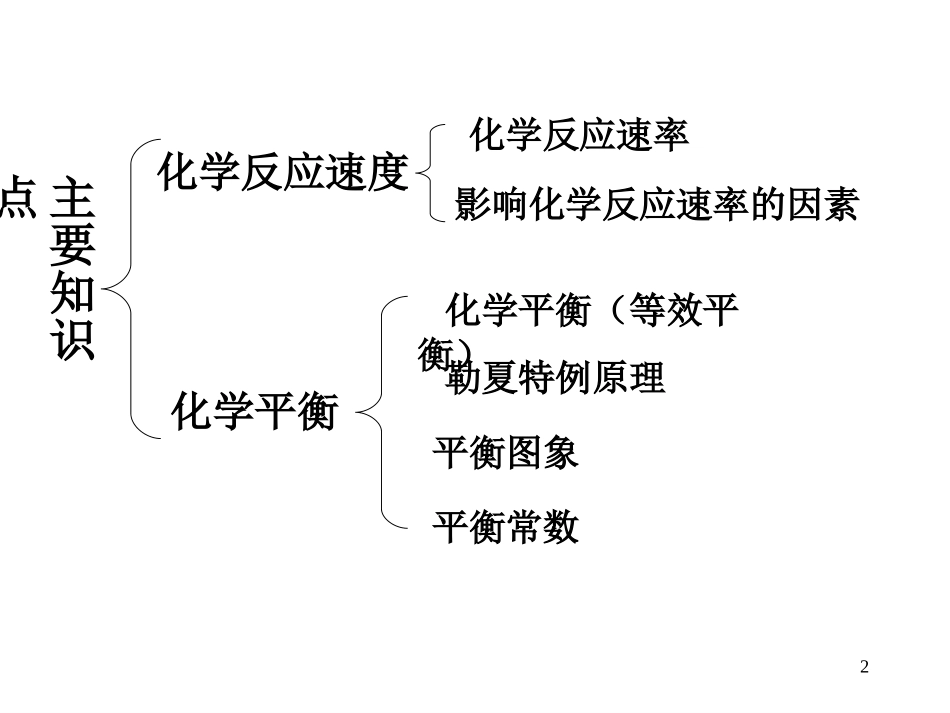
12主要知识点化学反应速度化学平衡化学反应速率化学平衡(等效平衡)平衡图象影响化学反应速率的因素勒夏特例原理平衡常数3一、化学反应速度1.反应速率mol/(L·min)或mol/(L·s)v(B)=tc(B)(1)反应速率的定义:(2).反应速率的表达式:(3).反应速率的单位:(4).同一反应中不同物质表示的速率之间的关系:①.同一条件下的同样时间段:mA+nBpC+qD②.不同条件下反应进行的快慢:v(A)m=v(B)n=v(C)p=v(D)q42.影响化学反应速度的因素(1).内因:反应物的性质(主要因素)(2).外因:(在其他条件不变的条件下)④催化剂:①浓度:浓度大反应速率大单位体积中的活化分子数增多有效碰撞次数增多压强大反应速率大单位体积中的活化分子数增多有效碰撞次数增多③温度:②压强:温度高反应速率大增大活化分子数的百分数有效碰撞次数增多使用催化剂反应速率明显增大降低活化能,增大活化分子数的百分数有效碰撞次数增多在恒温恒容(或恒温恒压)容器中充入惰性气体,对反应速率有何影响?5二、化学平衡1、可逆反应(1)“两同一反”:(2)可逆反应中有关物质的量及反应进行的方向:①“极限法”:②浓度商与平衡常数:Qc=K平衡Qc<K反应正向进行Qc>K反应逆向进行62、化学平衡状态(1)化学平衡的建立:vt0v正v逆v正=v逆t1(2)化学平衡的特点:逆、等、定、动、移(3)可逆反应达到化学平衡的标志:等、定、其它7(4)等效平衡:化学平衡的建立与途径无关。若不同的起始状态,达到平衡时各组分的百分含量相等,均为“等效平衡”。恒温恒容“一边倒”起始量相同“一边倒”起始量之比相同前后气体计量数之和不同前后气体计量数之和相同恒温恒压起始量之比相同“一边倒”前后气体计量数之和同(或不同)82、平衡移动原理(勒夏特列原理)(1)条件改变—v(正)、v(逆)变化—化学平衡移动:vt0v正v逆t1t2增大反应物浓度vt0v正v逆t1t2减小反应物浓度vt0v正v逆t1t2增大压强vt0v正v逆t1t2降低温度2N2(g)+3H2(g)2NH3(g)H△<0平衡正向移动平衡逆向移动平衡正向移动平衡正向移动9如果改变影响平衡的一个条件(浓度、温度、压强等),平衡就向能够使这种改变减弱的方向移动。改变的条件平衡移动的方向增大反应物或减小生成物浓度减小反应物或增大生成物浓度升高体系温度降低体系温度增大体系压强减小体系压强正反应方向逆反应方向吸热反应方向放热反应方向气体体积缩小的方向气体体积增大的方向(2)平衡移动原理(勒夏特例原理):催化剂对化学平衡移动没有影响,能缩短达到平衡所需的时间。10mA+nBpC+qD(1)反应物的转化率=n(已转化)n(起始)×100%c(已转化)c(起始)×100%=(2)平衡常数K=cm(A)·cn(B)cp(C)·cq(D)化学平衡常数与方程式的书写(计量数)有关化学平衡常数只受温度影响:放热反应温度升高逆向移动K减小温度降低正向移动K增大吸热反应温度升高正向移动K增大温度降低逆向移动K减小化学反应中各反应物的起始量与计量数成比例时,各反应物的转化率相同(3)“三组量”进行计算三、化学平衡常数11(4)平衡移动—反应物的转化率—平衡常数的关系温度引起平衡正向移动,反应物的转化率一定增大,平衡常数一定增大压强引起平衡正向移动,反应物的转化率一定增大,平衡常数不变12反应物用量改变(恒温恒容),平衡常数不变.若mA(g)nB(g)+pC(g),增加A的量,平衡正向移动m=n+pA的转化率不变m<n+pA的转化率减小m>n+pA的转化率增大若mA(g)+nB(g)pC(g)+qD(g)增加A的量,平衡正向移动,A的转化率减小,B的转化率增大按比例同倍数增加A和B的量,平衡正向移动,m+n=p+qA、B的转化率都不变m+n<p+qA、B的转化率都减小m+n>p+qA、B的转化率都增大容器模型13四、化学反应速率和化学平衡中的图象(1)能分析图象(2)平衡图象的主要类型①明确图象坐标的含义②明确图象中点(起始、转折、终结)的含义③明确图象变化趋势与化学变化过程的关系③含量-时间-温度(压强)图象“定一议二,用原理”①速率-时间图象②浓度(转化率)-时间图象“先拐先平,正作用”④恒压(温)图象14