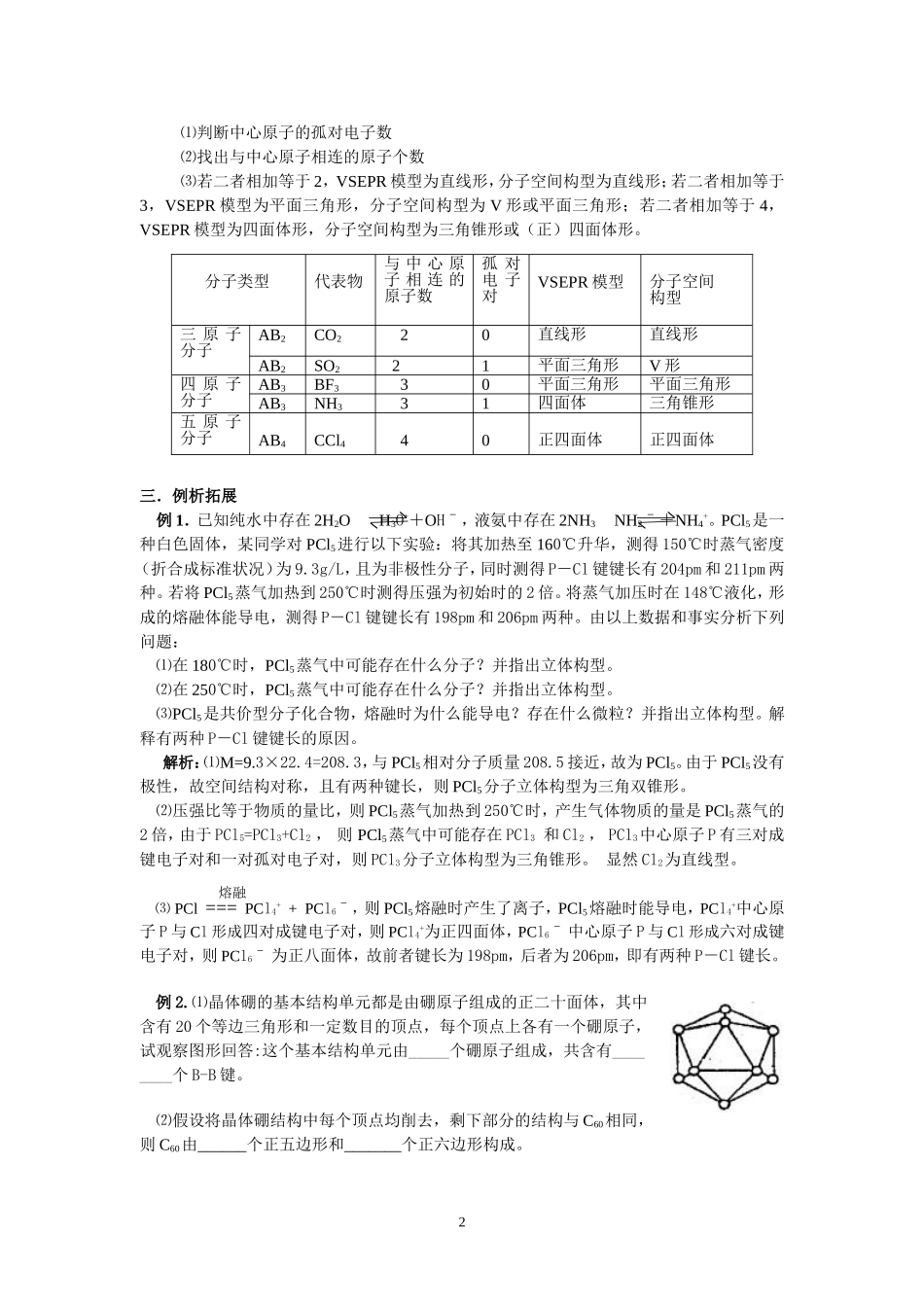
分子空间构型确定方法安徽省枞阳县枞阳中学施其胜246700电话:13855616390所谓“分子立体结构”是指组成分子中的原子的空间关系问题。显然,由两个原子组成的分子空间构型是直线形,但大多数分子是由两个以上原子构成的,那么,如何预测和确定多原子分子的空间构型呢。为了解释分子的空间结构,发展了多种结构理论。一.价层电子对互斥(VSEPR)模型1.理论模型分子中的价电子对(包括成键电子对和孤对电子对),成键电子对和孤对电子对会影响分子的空间构型,由于分子中的成键电子对及中心原子上的孤对电子对相互排斥,结果趋向尽可能彼此远离,以减小斥力,分子尽可能采取对称的空间构型。2.价电子对之间的斥力⑴电子对之间的排斥越大,夹角越小;⑵由于成键电子对受两个原子核的吸引,则电子云比较紧缩,而孤对电子对只受到中心原子的吸引,电子云比较“肥大”,对邻近的的电子对的斥力较大,故电子对之间的斥力大小顺序依次为:孤对电子对—孤对电子对>孤对电子对—成键电子对>成键电子对—成键电子对;⑶由于三键、双键比单键包含的电子数多,故斥力大小顺序依次为:三键>双键>单键。3.VSEPR模型的类型价层电子对互斥(VSEPR)模型指的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子对。⑴当中心原子的价电子都用于成键,无孤对电子时,价层电子对的空间构型与对应的分子空间构型相同。对ABn型分子,B围绕A成键,则A为中心原子,n值为中心原子直接结合的原子数。其分子空间构型可用中心原子周围的原子数n预测:n=2,直线形,如CO2;n=3,平面三角形,如CH2O;n=4,正四面体形,如CH4。⑵当中心原子有孤对电子时,其要占据中心原子周围的空间,并参与互相排斥,使分子呈现的不同立体构型,价层电子对的空间构型与对应的分子空间构型不同。如H2O和NH3的中心原子上分别有2对和1对孤对电子,跟中心原子周围的成键电子对加起来都是4,它们互相排斥,价层电子对的空间构型同为四面体,但分子空间构型H2O为V形,NH3为三角锥形,并且孤对电子对比成键电子对更靠近原子核,它对相邻成键电子对的排斥作用较大,为使电子对相互排斥最小,那么H2O、NH3分子相应的键角必然逐渐变小,H2O分子中的两个H—O键键角为105°,NH3分子中的N—H键之间键角为107°。VSEPR模型是模型化方法的具体体现,它把原子数相同、价电子数相同的一类化学粒子的结构加以概括,体现了等电子原理的思想。VSEPR模型预测分子立体结构方法:首先确定中心原子的价层电子对数判断分子的VSEPR模型(注意:分子中的双键、三键要作为一对电子看待),然后确定中心原子是否有孤对电子来确定分子的立体结构。二.分子空间构型与VSEPR模型关系价层电子对互斥模型是为了解释分子的立体结构,所以应学会利用这种理论判断某些分子、离子的空间立体结构。其一般规律为:1⑴判断中心原子的孤对电子数⑵找出与中心原子相连的原子个数⑶若二者相加等于2,VSEPR模型为直线形,分子空间构型为直线形;若二者相加等于3,VSEPR模型为平面三角形,分子空间构型为V形或平面三角形;若二者相加等于4,VSEPR模型为四面体形,分子空间构型为三角锥形或(正)四面体形。三.例析拓展例1.已知纯水中存在2H2OH3O++OHˉ,液氨中存在2NH3NH2ˉ+NH4+。PCl5是一种白色固体,某同学对PCl5进行以下实验:将其加热至160℃升华,测得150℃时蒸气密度(折合成标准状况)为9.3g/L,且为非极性分子,同时测得P-Cl键键长有204pm和211pm两种。若将PCl5蒸气加热到250℃时测得压强为初始时的2倍。将蒸气加压时在148℃液化,形成的熔融体能导电,测得P-Cl键键长有198pm和206pm两种。由以上数据和事实分析下列问题:⑴在180℃时,PCl5蒸气中可能存在什么分子?并指出立体构型。⑵在250℃时,PCl5蒸气中可能存在什么分子?并指出立体构型。⑶PCl5是共价型分子化合物,熔融时为什么能导电?存在什么微粒?并指出立体构型。解释有两种P-Cl键键长的原因。解析:⑴M=9.3×22.4=208.3,与PCl5相对分子质量208.5接近,故为PCl5。由于PCl5没有极性,故空间结构对称,且有两种键长,则PCl5分子立体构型为三角双锥形。⑵压强...