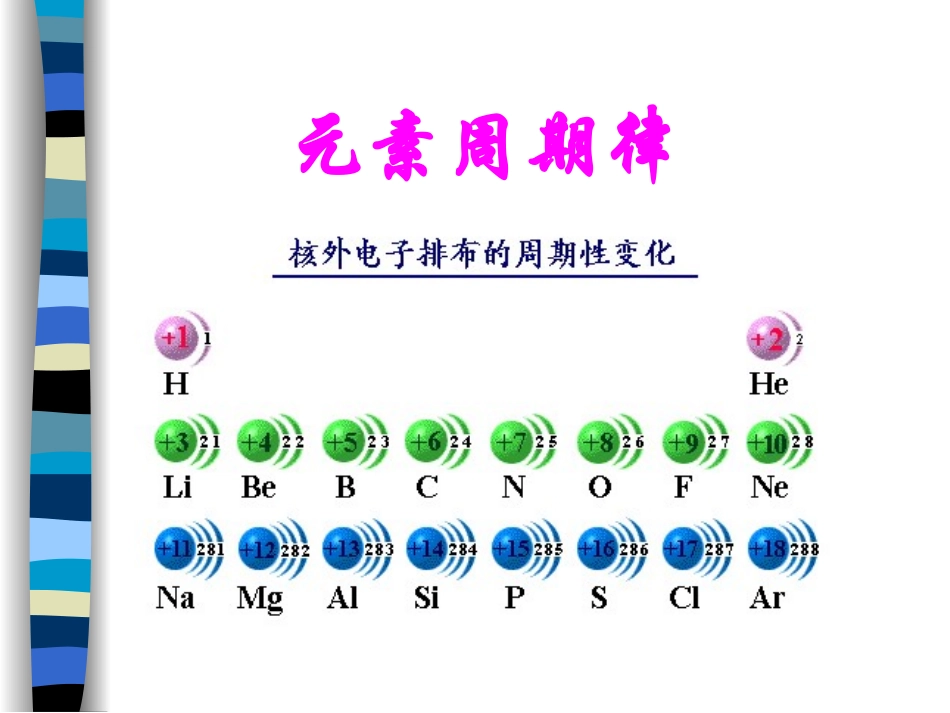
元素周期律随着原子序数的递增元素原子的核外电子排布呈现周期性变化元素原子半径呈现周期性变化元素化合价呈现周期性变化元素化学性质与原子结构的关系判断元素金属性强弱的方法1、单质跟水(或酸)反应置换出氢的难易2、最高价氧化物的水化物—氢氧化物的碱性强弱判断元素非金属性强弱的方法2、最高价氧化物的水化物的酸性强弱1、单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性钠、镁、铝和水的反应2Na+2H2O=2NaOH+H2Mg+2H2O=Mg(OH)2+H2金属性Na>Mg向盛有已擦去表面氧化膜的镁条和铝片的试管中,各加入2mL1mol/L的盐酸。镁、铝和盐酸的反应Mg+2HCl=MgCl2+H22Al+6HCl=2AlCl3+3H2镁、铝和盐酸的反应金属性Mg>Al原子序数111213元素符号NaMgAl单质与水(或酸)反应情况氢氧化物碱性强弱冷水剧烈热水较快盐酸剧烈盐酸较快NaOHMg(OH)2Al(OH)3金属性Na>Mg>Al金属性Na>Mg>Al强碱中强碱?氯化铝溶液和氢氧化钠溶液的反应取少量1mol/LAlCl3溶液注入试管中,加入3mol/L的NaOH溶液至产生大量Al(OH)3白色絮状沉淀为止。将Al(OH)3沉淀分盛在两只试管中,然后在两只试管中分别加入3mol/LHCl溶液和3mol/LNaOH溶液。氢氧化铝和酸、碱的反应稀硫酸HClAl(OH)3NaOH既能跟酸反应,又能跟碱反应的氢氧化物,叫作两性氢氧化物。两性氢氧化物碱Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2OAl(OH)3是两性氢氧化物酸Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH–=AlO2–+2H2OAl(OH)3是两性氢氧化物象Al2O3这样,既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,叫做两性氧化物。两性氧化物AlCl3+H2OAl2O3+HCl623Al2O3+NaOHAl2O3+6H+2Al3++3H2ONaAlO2+H2O22Al2O3+2OH–2AlO2–+H2O原子序数111213元素符号NaMgAl单质与水(或酸)反应情况氢氧化物碱性强弱冷水剧烈热水较快盐酸剧烈盐酸较快NaOH强碱Mg(OH)2中强碱Al(OH)3?金属性Na>Mg>AlAl(OH)3两性氢氧化物冷水剧烈热水较快盐酸剧烈盐酸较快NaOH强碱Mg(OH)2中强碱金属性Na>Mg>Al原子序数111213元素符号NaMgAl单质与水(或酸)反应情况氢氧化物碱性强弱金属性Na>Mg>Al原子序数14151617元素符号SiPSCl单质与H2化合的难易气态氢化物的稳定性最高价氧化物对应水化物的酸性H4SiO4极弱酸H3PO4中强酸H2SO4强酸HClO4最强酸高温光照或点燃爆炸化合磷蒸气加热非金属性Si