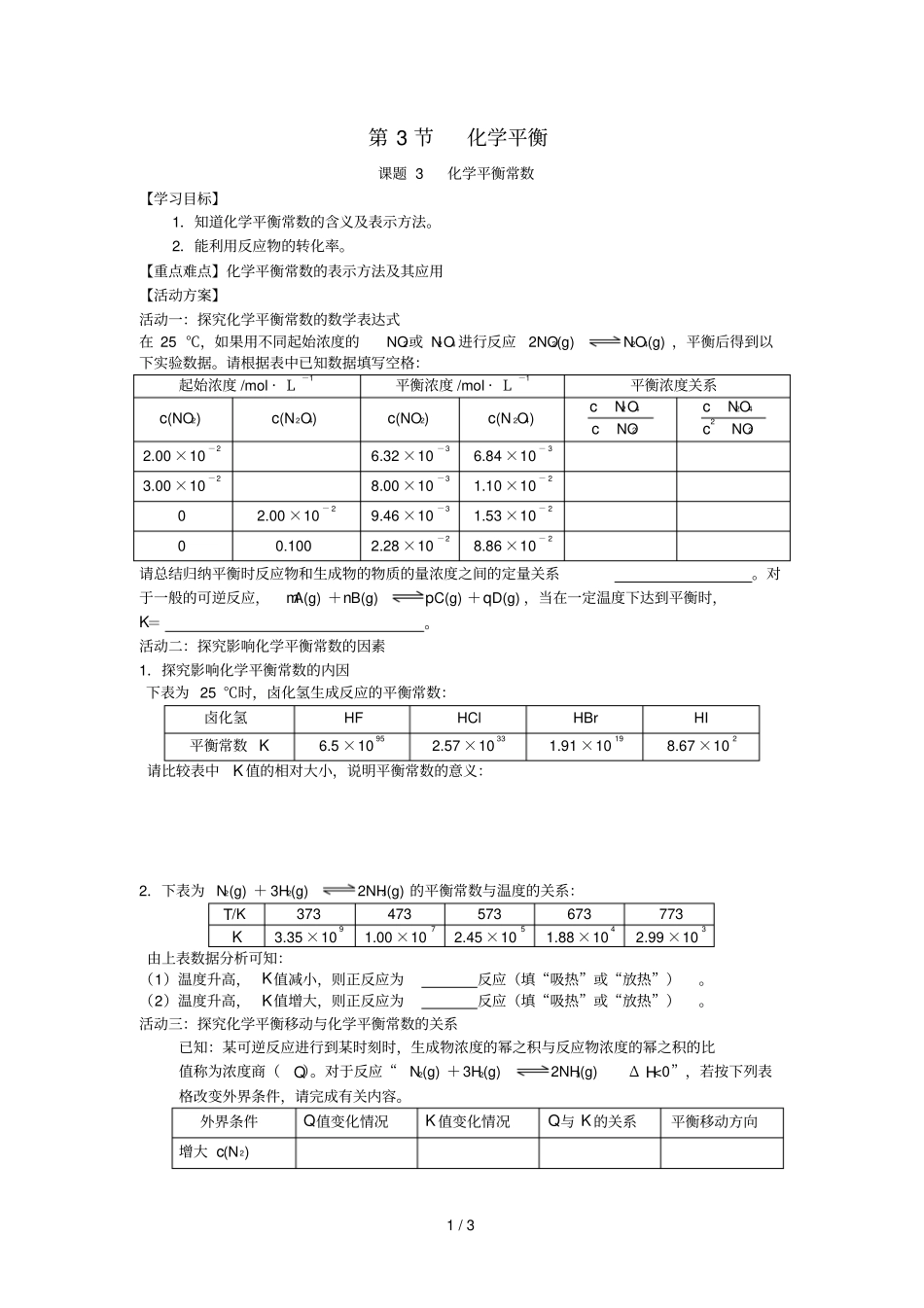
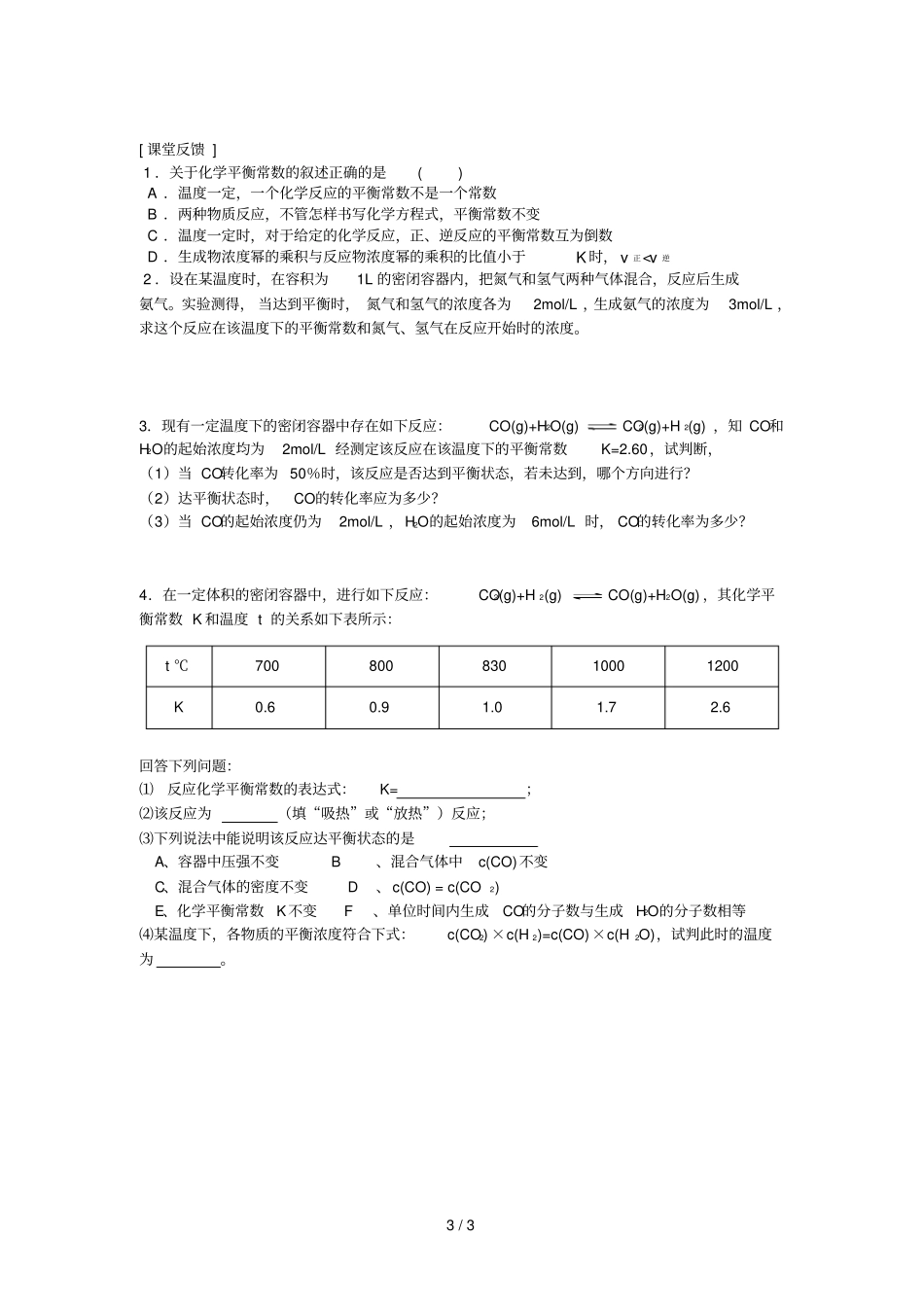
1/3第3节化学平衡课题3化学平衡常数【学习目标】1.知道化学平衡常数的含义及表示方法。2.能利用反应物的转化率。【重点难点】化学平衡常数的表示方法及其应用【活动方案】活动一:探究化学平衡常数的数学表达式在25℃,如果用不同起始浓度的NO2或N2O4进行反应2NO2(g)N2O4(g),平衡后得到以下实验数据。请根据表中已知数据填写空格:起始浓度/mol·L-1平衡浓度/mol·L-1平衡浓度关系c(NO2)c(N2O4)c(NO2)c(N2O4)cN2O4cNO2cN2O4c2NO22.00×10-26.32×10-36.84×10-33.00×10-28.00×10-31.10×10-202.00×10-29.46×10-31.53×10-200.1002.28×10-28.86×10-2请总结归纳平衡时反应物和生成物的物质的量浓度之间的定量关系。对于一般的可逆反应,mA(g)+nB(g)pC(g)+qD(g),当在一定温度下达到平衡时,K=。活动二:探究影响化学平衡常数的因素1.探究影响化学平衡常数的内因下表为25℃时,卤化氢生成反应的平衡常数:卤化氢HFHClHBrHI平衡常数K6.5×10952.57×10331.91×10198.67×102请比较表中K值的相对大小,说明平衡常数的意义:2.下表为N2(g)+3H2(g)2NH3(g)的平衡常数与温度的关系:T/K373473573673773K3.35×1091.00×1072.45×1051.88×1042.99×103由上表数据分析可知:(1)温度升高,K值减小,则正反应为反应(填“吸热”或“放热”)。(2)温度升高,K值增大,则正反应为反应(填“吸热”或“放热”)。活动三:探究化学平衡移动与化学平衡常数的关系已知:某可逆反应进行到某时刻时,生成物浓度的幂之积与反应物浓度的幂之积的比值称为浓度商(Q)。对于反应“N2(g)+3H2(g)2NH3(g)ΔH<0”,若按下列表格改变外界条件,请完成有关内容。外界条件Q值变化情况K值变化情况Q与K的关系平衡移动方向增大c(N2)2/3增大c(NH3)增大压强升高温度使用催化剂说明:Q与K的关系用“>”、“<”或“=”表示。活动四:学会有关化学平常数的简单计算1.在某温度下,将H2和I2各0.10mol的气体混合物充入10L的密闭容器中,充分反应,达到下列平衡:H2(g)+I2(g)2HI(g),测得c(H2)=0.0080mol/L。(1)求该反应的平衡常数为。(2)上述温度下,该容器中若通入H2和I2各0.20mol,则达到化学平衡状态是各物质的量浓度分别是多少?2.在密闭容器中,将2.0mol一氧化碳和2.0mol水蒸气的混合气体加热到800℃,在催化剂存在下发生反应:CO(g)+H2O(g)CO2(g)+H2(g)。达到平衡常数时K=1.0(1)求CO转化为CO2的转化率。(2)若开始时水的物质的量为10mol,其他条件不变,求CO转化为CO2的转化率。3/3[课堂反馈]1.关于化学平衡常数的叙述正确的是()A.温度一定,一个化学反应的平衡常数不是一个常数B.两种物质反应,不管怎样书写化学方程式,平衡常数不变C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数D.生成物浓度幂的乘积与反应物浓度幂的乘积的比值小于K时,v正