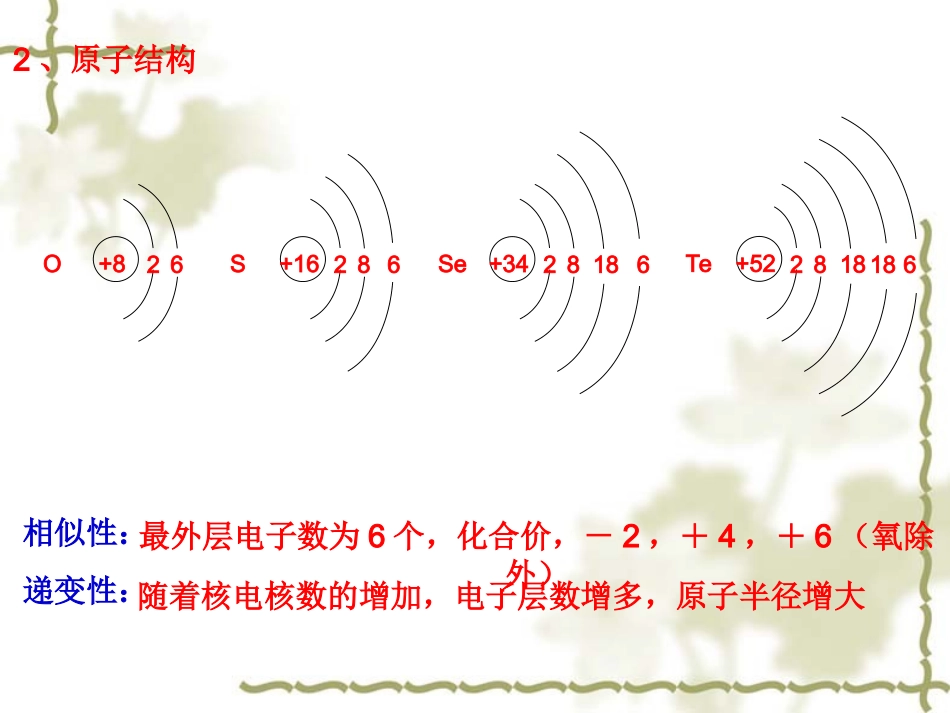
元素周期表3Li6.94111Na22.9919K39.1037Rb85.4755Cs132.987Fr[223]OSSeTePo一、氧族元素1、位置2、原子结构+826O+1628S6+3428Se186+5228Te18186相似性:递变性:最外层电子数为6个,化合价,-2,+4,+6(氧除外)随着核电核数的增加,电子层数增多,原子半径增大3.氧族元素单质的化学性质元素名称和符号氧(O)硫(S)硒(Se)碲(Te)核电荷数8163452化合价-2(无正价)-2,+4,+6-2,+4,+6-2,+4,+6跟H2反应燃烧或爆炸加热时能化合加热时能化合不直接化合氢化物(H2X)的热稳定性很稳定,1000℃以上分解300℃以上分解不稳定,加热即分解不稳定,0℃即分解氧化物无SO2,SO3SeO2,SeO3TeO2,TeO3最高价氧化物的水化物无H2SO4H2SeO4H2TeO4,元素的非金属性稳定性:减弱非金属性减弱二、硫及其重要化合物的性质练习1、下列物质通过两种单质直接化合得()A、FeCl2B、FeSC、CuSD、Cu2SB、D单质硫与非金属、与金属反应(与变价金属反应时生成低价态的金属硫化物),说明硫的氧化性较弱。性质1、单质硫的性质H2SH2SO3SSO2SO3H2SO4Na2SO4FeSBaSO4⑴⑵⑶⑷⑸⑹⑺⑻⑼⑽⑾⑿⒀⒁练习2、把SO2通入下列物质a紫色石蕊b溴水cKMnO4d氢硫酸e品红f氢氧化钠(1)各装置的现象:___________________________________________________Br2+SO2+2H2O=2HBr+H2SO4(2)a、体现了SO2的________性b、中的化学反应为:________________________(3)c中体现SO2的____性(4)d、体现SO2______性。反应方程式为:________________________(5)e、中加热的现象_______(6)f、中离子方程式:_______________________酸还原氧化2H2S+SO2=3S↓+2H2OSO2+2OH-=SO32-+H2O恢复红色d、淡黄色沉淀a、变红b、褪色c、褪色e、褪色f、无明显现象①、为酸性氧化物②、既有氧化性,又有还原性③、有漂白性强调漂白原理原理:实例变化与某些有机色质结合成无色不稳定的化合物SO2化学(暂时性)强氧化性Na2O2HClO、O3H2O2等化学(永久性)吸附作用活性炭物理性质2、SO2的性质【讨论】请设计一套实验装置生成SO2并证明SO2有氧化性、还原性和漂白性。思考:SO2既具有氧化性又具有还原性,请你判断能否用浓硫酸来干燥SO2?说明你的理由.(浓硫酸具强氧化性)不同价态的硫元素之间的转化关系不同价态的硫元素之间的转化关系邻价无奈间价归邻价无奈间价归如如HH22SS与与SS、、SS与与SOSO22、、SOSO22与浓与浓HH22SOSO44等等,,不发生氧化还不发生氧化还原反应。原反应。而而:2H:2H22S+SOS+SO22==S↓+2H==S↓+2H22O;O;HH22S+HS+H22SOSO4(4(浓浓))==加热加热=SO=SO22↑↑+S↓+2H+S↓+2H22OOHH22S+3HS+3H22SOSO4(4(浓浓))==加热加热=4SO=4SO22↑↑+4H+4H22OOS+2HS+2H22SOSO4(4(浓浓))==加热加热=3SO=3SO22↑+2H↑+2H22OO练习3、讨论如何鉴别一瓶稀硫酸和一瓶浓硫酸①硫酸具有酸的通性②浓硫酸的三大特性吸水脱水强氧化性密度状态用玻璃棒蘸取待测液点在白纸上敞口放置在空气中一段时间称量取少量取待测液分别加入铜片并加热取胆矾分别加入待测液观察现象在待测液中分别加入Fe或Al观察现象“黑色面包”性质3、硫酸的性质练习4、能够满足一种溶液中含有硫酸跟离子的事实是()A.加入用盐酸酸化过的氯化钡溶液有白色沉淀生成。B.加入氯化钡溶液,有白色沉淀,再加入稀硝酸,沉淀不溶。C.加入硝酸钡溶液,有白色沉淀生成。D.加入硝酸钡溶液,有白色沉淀生成,过滤后,在沉淀中加入盐酸沉淀不溶解。性质4、SO42-离子的检验被检液有白色沉淀出现,则有SO42-无白色沉淀出现,则无SO42-加足量盐酸酸化滴加BaCl2溶液取清液D污染物防治措施大气污染颗粒物、硫、氮的化合物、碳的氧化物、碳氢化合物、含卤素化合物、放射性物质等综合治理水污染金属、酸、碱、盐、耗氧物质、石油和难降解的有机物、洗涤剂等污水处理后再排放土壤污染城市污水、工业废水、生活垃圾、工矿企业废弃物、化肥、农药等控制和减少污染物的排放三、环境保护请把左侧的化学物质与右侧的环境问题联系起来SO2、NO2氟利昂洗涤剂(生活污水)CO2温室效应水体富营养化(赤潮)酸雨臭氧层破坏白色污染塑料汽油空气中铅、CO超标小结:一、氧族元素1、位置2、结构3、性质二、硫及其重要化合物1、单质硫...