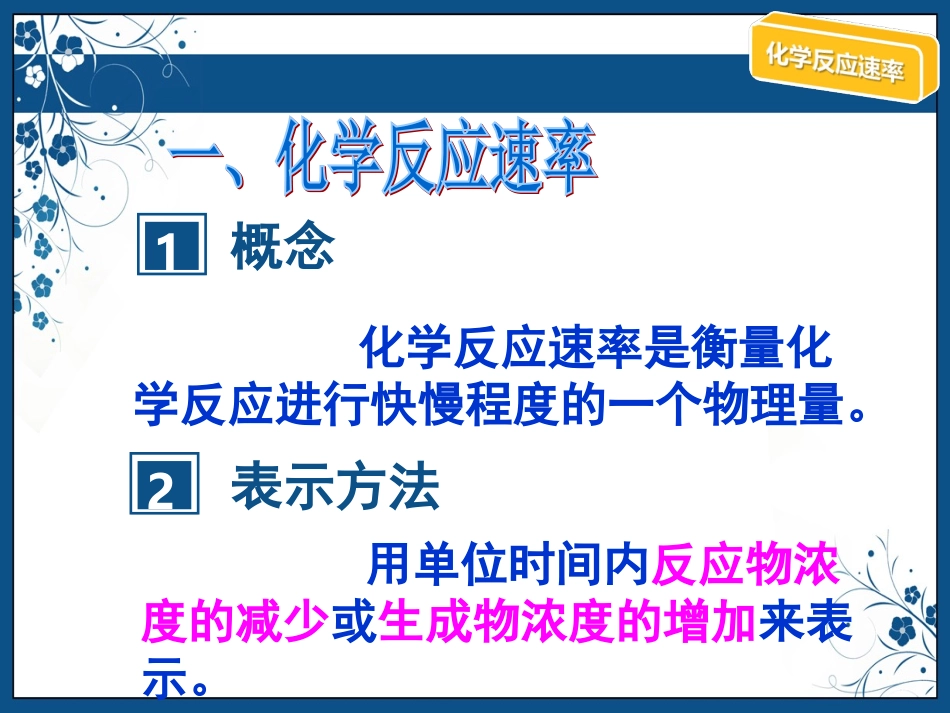
学习目标学习目标☆化学反应速率的表示方法☆化学反应速率的计算1概念化学反应速率是衡量化学反应进行快慢程度的一个物理量。2表示方法用单位时间内反应物浓度的减少或生成物浓度的增加来表示。3表达式以某反应物或生成物B为例01c(B)2c(B)Δc(B)0ttΔt124单位);/(或sLmolSLmol11单位:mol/L单位:s或mintBcBv)()(注意:浓度仅指溶液或气体,固体和纯液体无浓度可言。文本文本文本文本文本文本文本例1:某反应物B在1min内减少了1mol/L,则用B表示化学反应速率为1mol•L-1•min-11min1L1molΔtΔc(B)v(B)例2:某反应物B的初始浓度为2.0mol/L,经过2min后,B的浓度变成1.6mol/L,则2min内B的化学反应速率为1min1L2mol0ΔtΔc(B)v(B).例3:在2L的密闭容器中,加入1molN2和3molH2,发生N2+3H2=2NH3,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。解:N2+3H2=2NH3起始浓度(mol/L)变化浓度(mol/L)2S末浓度(mol/L)v(N2)=0.1/2mol/(L·s)=0.05mol/(L·s)v(H2)=0.3/2mol/(L·s)=0.15mol/(L·s)v(NH3)=0.2/2mol/(L·s)=0.1mol/(L·s)观察并回答:分别用不同物质表示的反应速率之间有什么关系?v(N2):v(H2):v(NH3)=1:3:20.51.500.41.20.20.10.30.2文本文本文本文本文本文本文本小结:对任意反应mA+nB=pC+qD)(:)(:)(:)(DcCcBcAc)(:)(:)(:)(DnCnBnAntDcDvtCcCv)()()()(tBcBvtAcAv)()()()(1、qpnmDvCvBvAv:::)(:)(:)(:)(2、qDvpCvnBvmAv)()()()(3、文本文本文本文本文本文本文本例4:反应A+3B=2C+2D,已知某一时间内A的反应速率为2mol·L-1·s-1,则B的反应速率为,C的反应速率为。例5:反应N2+3H2=2NH3在2L的密闭容器中发生,5s内NH3的质量增加了1.7g,求NH3的反应速率,H2的反应速率,N2的反应速率6mol•L-1•s-14mol•L-1•s-10.01mol•L-1•s-10.015mol•L-1•s-10.005mol•L-1•s-1结论1:同一个反应,用不同的物质来表示反应速率,数值一般是不一样的,但意义相同,所以反应速率应注明是由哪种物质表示的。结论2:同一反应中,各物质的速率之比等于他们在化学方程式中的化学计量数之比。结论3:化学反应速率随反应的进行可不断变化,我们所说的速率是指在整个过程中的平均速率,不是瞬时速率。且均为正值。1、用不同的物质来表示反应速率例1、反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为()A.v(O2)=0.010mol/(L·s)B.v(NO)=0.008mol/(L·s)C.v(H2O)=0.003mol/(L·s)D.v(NH3)=0.002mol/(L·s)v(NO)=0.3mol/(5L×30s)=0.002mol/(L·s)CD2、比较反应速率的大小例2、反应A+3B==2C+2D在四种不同情况下的反应速率分别为①VA=0.15mol·L-1·s-1V②B=0.6mol·L-1·s-1③Vc=0.4mol·L-1·s-1V④D=0.45mol·L-1·s-1则该反应的速率快慢顺序是④﹥②=③﹥①结论4:在同一反应中,反应速率的大小不能单纯地看数值大小。应化为同种物质、相同单位时,再做比较。②VA=0.2mol·L-1·s-1③VA=0.2mol·L-1·s-1④VA=0.225mol·L-1·s-13、根据各物质的反应速率之比写出化学方程式例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过tmin后,测得物质的量浓度分别为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:3X2+Y2===2Z3X2+Y2===2X3Y