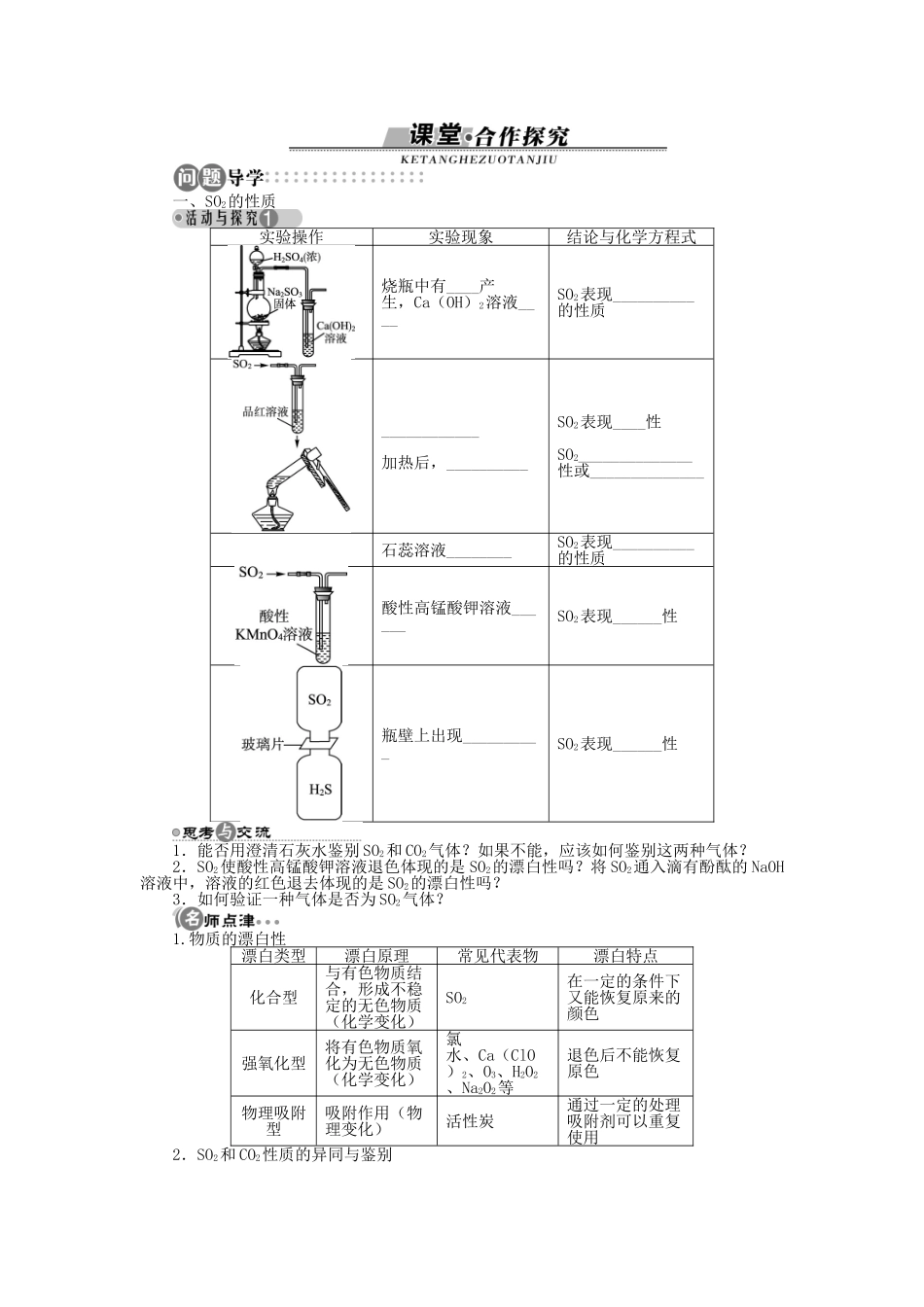
第2课时实验室里研究不同价态硫元素间的转化酸雨及其防治学习目标重点难点1.了解二氧化硫的物理性质,掌握二氧化硫的化学性质及用途;2.认识浓硫酸的强氧化性;3.通过实验探究不同价态硫元素的相互转化,掌握运用氧化还原反应寻找合适的氧化剂和还原剂;4.了解酸雨的形成及危害,加强环保意识1.掌握二氧化硫的物理性质、氧化性、还原性等性质的表现,了解其漂白性;2.掌握浓硫酸的氧化性与稀硫酸的氧化性的区别及SO的检验;3.能熟练地用化学方程式、离子方程式表达不同价态硫元素的相互转化关系;4.初步认识关系式法在化学计算中的应用一、氧化性、还原性与化合价的关系硫元素的价态最高价(+6)中间价(0、+4)最低价(-2)硫元素所表现的性质二、硫的几种重要化合物1.SO2(1)物理性质颜色气味密度水溶性毒性比空气的密度__(2)化学性质预习交流SO2与HClO的漂白原理是否相同?2.浓硫酸(1)吸水性:浓硫酸有强烈的吸水性,常用作________。(2)脱水性:浓硫酸能将某些有机物中的氢、氧元素按______的比例脱出生成H2O。(3)强氧化性预习交流1.如何稀释浓硫酸?2.浓硫酸作干燥剂时不能干燥哪些气体?三、酸雨及其防治1.酸雨的形成(1)酸雨:排入空气中的______________在O2和水蒸气的共同作用下,形成酸雾,随雨水降落就成为酸雨。(2)硫的氧化物形成酸雨的主要过程:①________________,②__________________,③________________,④__________________。2.酸雨的防治措施(1)从实际情况出发,对__________的排放加以控制;(2)改变能源结构,开发利用________________等清洁能源,从根本上解决问题。预习交流pH<7的雨水都是酸雨吗?答案:一、只有氧化性既有氧化性,又有还原性只有还原性二、1.(1)无色刺激性气味大易溶于水有毒(2)SO2+H2OH2SO3SO2+2NaOH===Na2SO3+H2OSO2+CaO===CaSO3SO2+2H2S===3S↓+2H2O2SO2+O22SO3SO2+Br2+2H2O===H2SO4+2HBrH2SO3恢复原来的颜色预习交流:答案:不相同。HClO的漂白性是由于HClO的强氧化性所致,且漂白后不能恢复原色,而SO2的漂白性是SO2与有色物质化合生成不稳定的无色物质,这些无色物质易分解而恢复原色。2.(1)干燥剂(2)2∶1(3)Cu+2H2SO4(浓)=====CuSO4+2H2O+SO2↑钝化C+2H2SO4(浓)=====CO2↑+2SO2↑+2H2O预习交流:1.答案:将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,使产生的热量及时散失。2.答案:浓硫酸是酸性干燥剂,不能干燥碱性气体,如NH3;浓硫酸有强氧化性,不能干燥还原性气体,如H2S、HBr、HI等。三、1.(1)SO2和氮氧化物(2)SO32SO2+O22SO3SO3+H2O===H2SO4SO2+H2OH2SO32H2SO3+O2===2H2SO42.(1)酸性物质(2)氢能、风能、太阳能预习交流:答案:不是。正常雨水由于溶解了CO2而呈微弱的酸性,只有当pH<5.6时,才认为是酸雨。在预习中还有哪些问题需要你在听课时加以关注?请在下列表格中做个备忘吧!我的学困点我的学疑点一、SO2的性质实验操作实验现象结论与化学方程式烧瓶中有____产生,Ca(OH)2溶液____SO2表现__________的性质____________加热后,__________SO2表现____性SO2______________性或______________石蕊溶液________SO2表现__________的性质酸性高锰酸钾溶液______SO2表现______性瓶壁上出现__________SO2表现______性1.能否用澄清石灰水鉴别SO2和CO2气体?如果不能,应该如何鉴别这两种气体?2.SO2使酸性高锰酸钾溶液退色体现的是SO2的漂白性吗?将SO2通入滴有酚酞的NaOH溶液中,溶液的红色退去体现的是SO2的漂白性吗?3.如何验证一种气体是否为SO2气体?1.物质的漂白性漂白类型漂白原理常见代表物漂白特点化合型与有色物质结合,形成不稳定的无色物质(化学变化)SO2在一定的条件下又能恢复原来的颜色强氧化型将有色物质氧化为无色物质(化学变化)氯水、Ca(ClO)2、O3、H2O2、Na2O2等退色后不能恢复原色物理吸附型吸附作用(物理变化)活性炭通过一定的处理吸附剂可以重复使用2.SO2和CO2性质的异同与鉴别SO2CO2相同点物理性质都是无色气体,密度都比空气的大与水的反应SO2+H2OH2SO3CO...