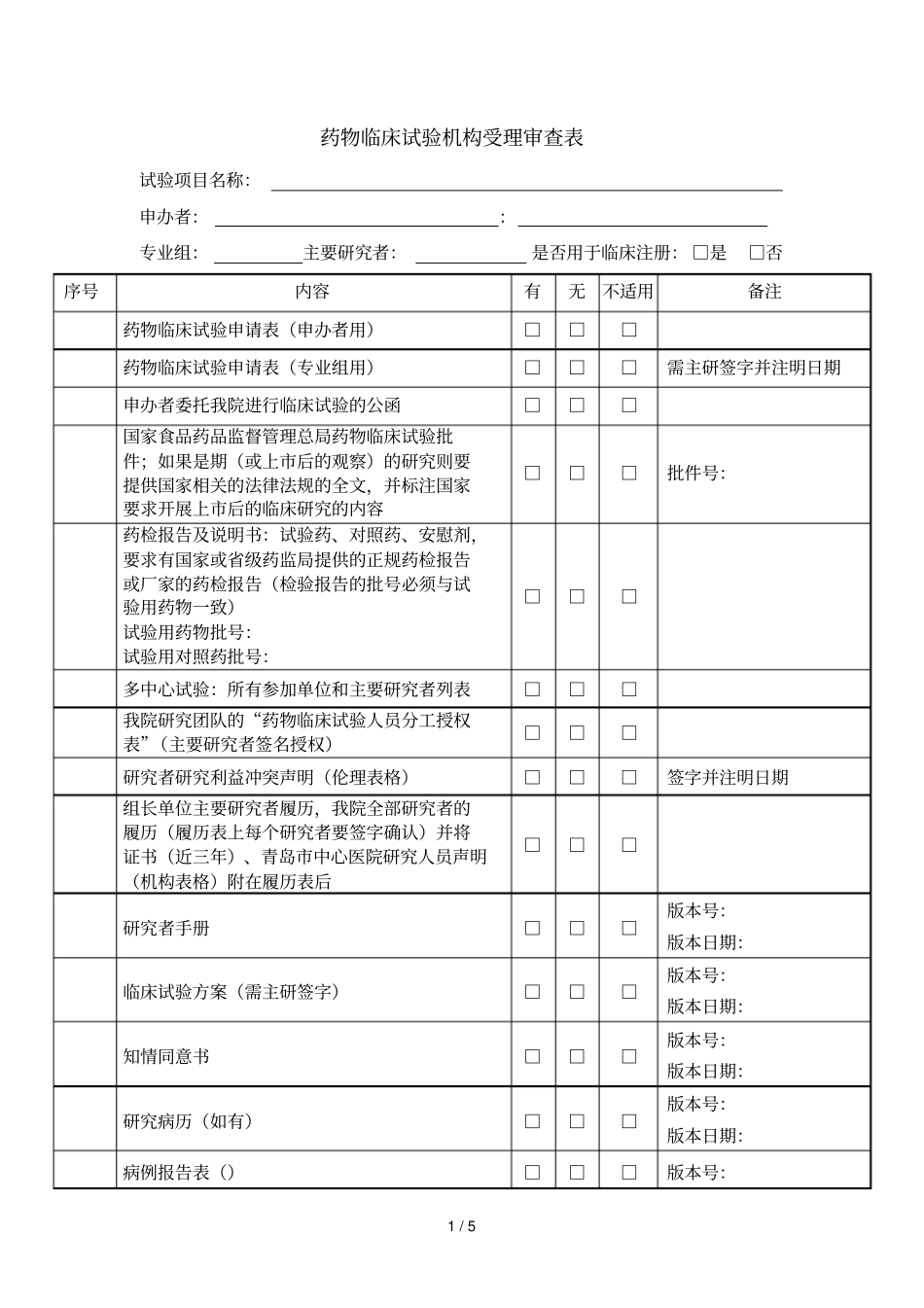
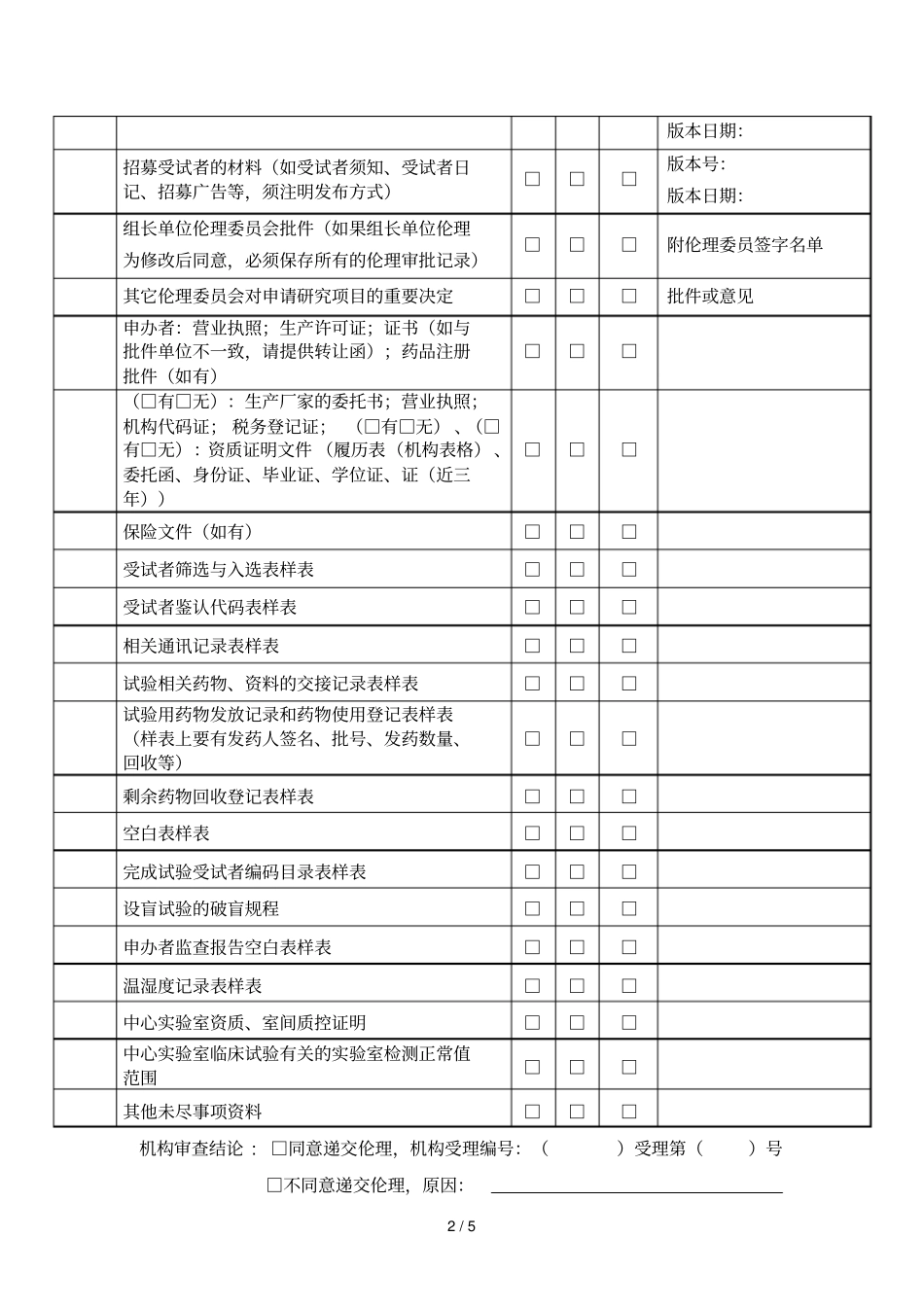
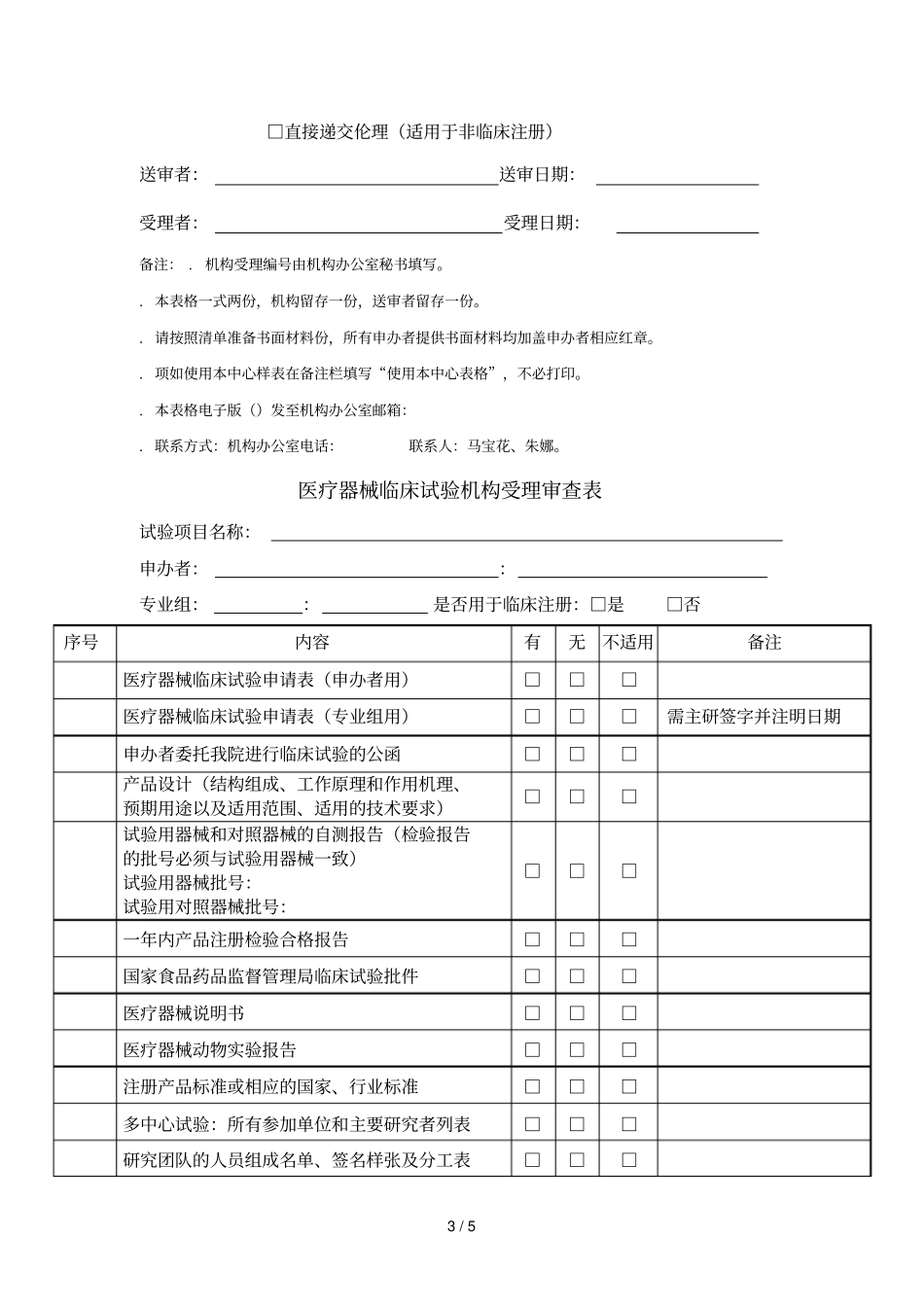
1/5药物临床试验机构受理审查表试验项目名称:申办者::专业组:主要研究者:是否用于临床注册:□是□否序号内容有无不适用备注药物临床试验申请表(申办者用)□□□药物临床试验申请表(专业组用)□□□需主研签字并注明日期申办者委托我院进行临床试验的公函□□□国家食品药品监督管理总局药物临床试验批件;如果是期(或上市后的观察)的研究则要提供国家相关的法律法规的全文,并标注国家要求开展上市后的临床研究的内容□□□批件号:药检报告及说明书:试验药、对照药、安慰剂,要求有国家或省级药监局提供的正规药检报告或厂家的药检报告(检验报告的批号必须与试验用药物一致)试验用药物批号:试验用对照药批号:□□□多中心试验:所有参加单位和主要研究者列表□□□我院研究团队的“药物临床试验人员分工授权表”(主要研究者签名授权)□□□研究者研究利益冲突声明(伦理表格)□□□签字并注明日期组长单位主要研究者履历,我院全部研究者的履历(履历表上每个研究者要签字确认)并将证书(近三年)、青岛市中心医院研究人员声明(机构表格)附在履历表后□□□研究者手册□□□版本号:版本日期:临床试验方案(需主研签字)□□□版本号:版本日期:知情同意书□□□版本号:版本日期:研究病历(如有)□□□版本号:版本日期:病例报告表()□□□版本号:2/5版本日期:招募受试者的材料(如受试者须知、受试者日记、招募广告等,须注明发布方式)□□□版本号:版本日期:组长单位伦理委员会批件(如果组长单位伦理为修改后同意,必须保存所有的伦理审批记录)□□□附伦理委员签字名单其它伦理委员会对申请研究项目的重要决定□□□批件或意见申办者:营业执照;生产许可证;证书(如与批件单位不一致,请提供转让函);药品注册批件(如有)□□□(□有□无):生产厂家的委托书;营业执照;机构代码证;税务登记证;(□有□无)、(□有□无):资质证明文件(履历表(机构表格)、委托函、身份证、毕业证、学位证、证(近三年))□□□保险文件(如有)□□□受试者筛选与入选表样表□□□受试者鉴认代码表样表□□□相关通讯记录表样表□□□试验相关药物、资料的交接记录表样表□□□试验用药物发放记录和药物使用登记表样表(样表上要有发药人签名、批号、发药数量、回收等)□□□剩余药物回收登记表样表□□□空白表样表□□□完成试验受试者编码目录表样表□□□设盲试验的破盲规程□□□申办者监查报告空白表样表□□□温湿度记录表样表□□□中心实验室资质、室间质控证明□□□中心实验室临床试验有关的实验室检测正常值范围□□□其他未尽事项资料□□□机构审查结论:□同意递交伦理,机构受理编号:()受理第()号□不同意递交伦理,原因:3/5□直接递交伦理(适用于非临床注册)送审者:送审日期:受理者:受理日期:备注:.机构受理编号由机构办公室秘书填写。.本表格一式两份,机构留存一份,送审者留存一份。.请按照清单准备书面材料份,所有申办者提供书面材料均加盖申办者相应红章。.项如使用本中心样表在备注栏填写“使用本中心表格”,不必打印。.本表格电子版()发至机构办公室邮箱:.联系方式:机构办公室电话:联系人:马宝花、朱娜。医疗器械临床试验机构受理审查表试验项目名称:申办者::专业组::是否用于临床注册:□是□否序号内容有无不适用备注医疗器械临床试验申请表(申办者用)□□□医疗器械临床试验申请表(专业组用)□□□需主研签字并注明日期申办者委托我院进行临床试验的公函□□□产品设计(结构组成、工作原理和作用机理、预期用途以及适用范围、适用的技术要求)□□□试验用器械和对照器械的自测报告(检验报告的批号必须与试验用器械一致)试验用器械批号:试验用对照器械批号:□□□一年内产品注册检验合格报告□□□国家食品药品监督管理局临床试验批件□□□医疗器械说明书□□□医疗器械动物实验报告□□□注册产品标准或相应的国家、行业标准□□□多中心试验:所有参加单位和主要研究者列表□□□研究团队的人员组成名单、签名样张及分工表□□□