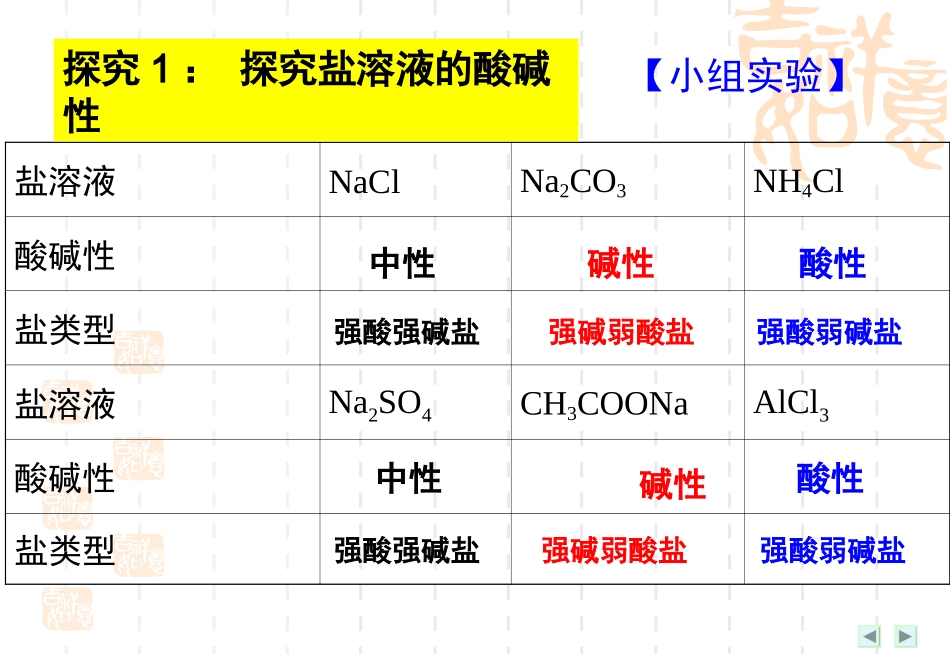
第三节盐类的水解(第一课时)【学习目标】1、理解盐类水解的实质2、掌握强酸弱碱盐和强碱弱酸盐水解的规律盐溶液NaClNa2CO3NH4Cl酸碱性盐类型盐溶液Na2SO4CH3COONaAlCl3酸碱性盐类型中性碱性酸性中性碱性酸性强酸强碱盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐探究1:探究盐溶液的酸碱性【小组实验】盐的类型强酸强碱盐强碱弱酸盐强酸弱碱盐盐溶液酸碱性中性碱性酸性弱酸弱碱盐溶液的酸碱性较复杂中学阶段不作要求探究1:探究盐溶液的酸碱性【小结】探究2:盐溶液呈现不同酸碱性的原因——探究盐类水解的实质H2OH++OH–纯水中:在水中加入NH4Cl形成溶液时,思考以下问题:(1)NH4Cl的电离方程式?(2)哪些粒子间可能结合(生成弱酸或弱碱)?(3)对水的电离平衡有何影响?(抑制或促进)(4)相关的化学方程式?在溶液中盐电离出来的弱酸阴离子或弱碱阳离子跟水所电离出来的H+或OH–结合生成弱电解质的反应,叫做盐类的水解。(弱酸、弱碱)1.盐类水解的概念:盐类水解能电离出弱酸阴离子或弱碱阳离子可溶性盐(有弱才水解,无弱不水解)2.水解的条件:3.水解的实质:盐电离出的弱酸阴离子或弱碱阳离子与水电离出的H+或OH-生成弱电解质;从而促进水的电离4.水解的显性规律:谁强显谁性;同强显中性HCO3–+H2OH2CO3+OH–CO32–+H2OHCO3–+OH–【信息提示】多元弱酸根的水解是分步进行的。如Na2CO3溶液中,其水解的离子方程式可表示为:探究3:盐类水解的离子方程式的书写盐类水解离子方程式的书写注意事项:1.先找“弱”离子。2.一般水解程度小,水解产物少。所以常用“”;不写“==”、“↑”、“↓”;也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式。⒊多元弱酸强碱的正盐:分步书写,步步可逆(以第一步为主)(H2O的系数始终为1)多元弱碱强酸的正盐:一步到位。探究3:盐类水解的离子方程式的书写【课堂小结】盐类水解:(1).水解的条件:(2).水解的实质:(3).水解的特点:(4).水解的显性规律:盐易溶,有弱酸阴离子或弱碱阳离子。(有弱才水解,无弱不水解)促进水的电离平衡。生成弱电解质;可逆;吸热;一般微弱;谁强显谁性;同强显中性。盐类水解离子方程式的书写(注意与有水参与的电离方程式的区别)