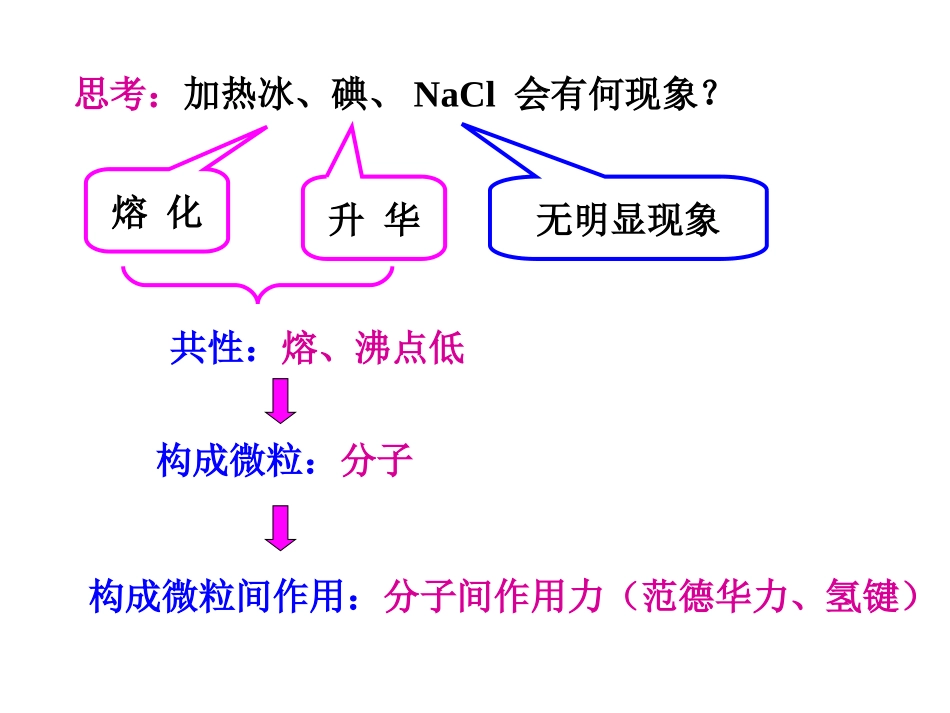
【自主学习】1、分子晶体中粒子的作用力有哪些?2、分子晶体的物理性质?3、典型的分子晶体有哪些?4、所有分子晶体中都存在化学键吗?5、分子晶体有什么结构特征?思考:加热冰、碘、NaCl会有何现象?熔化升华无明显现象构成微粒:分子构成微粒间作用:分子间作用力(范德华力、氢键)共性:熔、沸点低一、分子晶体:只含分子的晶体称为分子晶体。1、构成微粒:分子第三节原子晶体与分子晶体2、晶体中微粒间的作用力分子内:分子间:共价键分子间作用力(范德华力、氢键)决定分子晶体的熔、沸点3、分子晶体物理性质的共性:熔点低、易升华、硬度小导电性:通常,晶体本身不导电,熔融状态也不能导电。溶解性:相似相溶原理1、“所有分子内都有共价键”,这个说法对否?2、HClHBrHI想一想递减气态氢化物稳定性:沸点:递增决定因素:共价键键能决定因素:分子间作用力3、H2SO4(s)溶于水或熔融时分别破坏了什么作用?H2SO4(s)溶于水或熔融时导电情况如何?(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX(2)部分非金属单质:X2、O2、H2、S、P、C60(3)部分非金属氧化物:CO2、SO2、NO2、P4O6(4)几乎所有的酸:H2SO4、HNO3、H3PO4(5)大多数有机物的晶体:乙醇,冰醋酸,蔗糖4、典型的分子晶体例外:金刚石、晶体硅、晶体硼、石墨等例外:二氧化硅等以下晶体中哪些属于分子晶体?S、H2SO4、C60、尿素、He、NH3、SiO2、SO2、P4O6、P、Cl2、C(金刚石)、H2S、冰醋酸判断标准----只含分子√√√√√√√√√√√√想一想以上属于分子晶体的物质属于哪些类别?P36P36形形色色的分子形形色色的分子5、分子晶体的结构特征(1)分子间只有范德华力(少数分子晶体还有氢键)分子密堆积:每个分子周围有12个紧邻的分子如:C60、干冰、O2(2)分子间有氢键分子非密堆积:氢键具有方向性和饱和性,使晶体中的空间利用率不高,留有相当大的空隙。如:HF、NH3、冰(每个水分子周围只有4个紧邻的水分子)。(3)分子晶体中存在单个分子,化学式就是分子式,代表真实的分子组成。6、分子晶体熔、沸点高低的判断方法(重点)(1)少数以氢键作用形成的分子晶体,比一般的分子晶体的熔点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、氨基酸、糖等物质的熔点相对较高。(2)组成和结构相似,分子之间不含氢键而利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔点逐渐升高。例如,常温下Cl2为气态,Br2为液态,而I2为固态,CO2为气态,CS2为液态。(3)相对分子质量相等或相近的极性分子构成的分子晶体,其熔点一般比非极性分子构成的分子晶体的熔点高,如CO的熔点比N2的熔点高。(4)组成和结构相似且不存在氢键的同分异构体所形成的分子晶体,相对分子质量相同,一般支链越多,分子间相互作用越弱,熔、沸点越低,如正戊烷>异戊烷>新戊烷。1、下列分子晶体,关于熔沸点高低叙述中,正确的是()A.Cl2>I2B.SiCl4>CCl4C.NH3
CH3(CH2)3CH3B2、下列物质,按沸点降低顺序排列的一组是()A.HF、HCl、HBr、HIB.F2、Cl2、Br2、I2C.H2O、H2S、H2Se、H2TeD.CI4、CBr4、CCl4、CF4D科学视野可燃冰理想可燃冰化学式8CH4•46H2O,水分子通过氢键形成四边形、五边形或六边形,进而形成笼状多面体。1、HgCl2的稀溶液可作手术刀的消毒剂,已知其熔点是227℃,熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力,由下列关于HgCl2(s)的叙述中正确的是()①属于分子晶体;②属于离子化合物;③属于非电解质;④属于弱电解质。A.①③B.①④C.②③D.②④2、四氯化硅的结构和四氯化碳类似,对其性质的推断,正确的是()①四氯化碳晶体是分子晶体;②通常情况下为液态;③熔点高于四氯化碳;④属于正四面体的分子构型。A.①③B.①②C.③④D.全部3、下列物质的液体中,不存在分子是()A.二氧化硅B.二氧化硫C.二氧化碳D.二硫化碳OC范德华力共价键干冰的晶体结干冰的晶体结构构结构单元中N(CO2)=.在每个CO2周围与之距离最近且相等的CO2有____个124冰中冰中11个水分子周围有个水分子周围有44个水分子个水分子冰的结构冰的结构氢键具有方向性氢键具有方向性氢键具有饱和性CC6060晶体结构:晶体结构:①C60是晶体;②一个C60分子中σ键数目=。双键数=,单键数=。