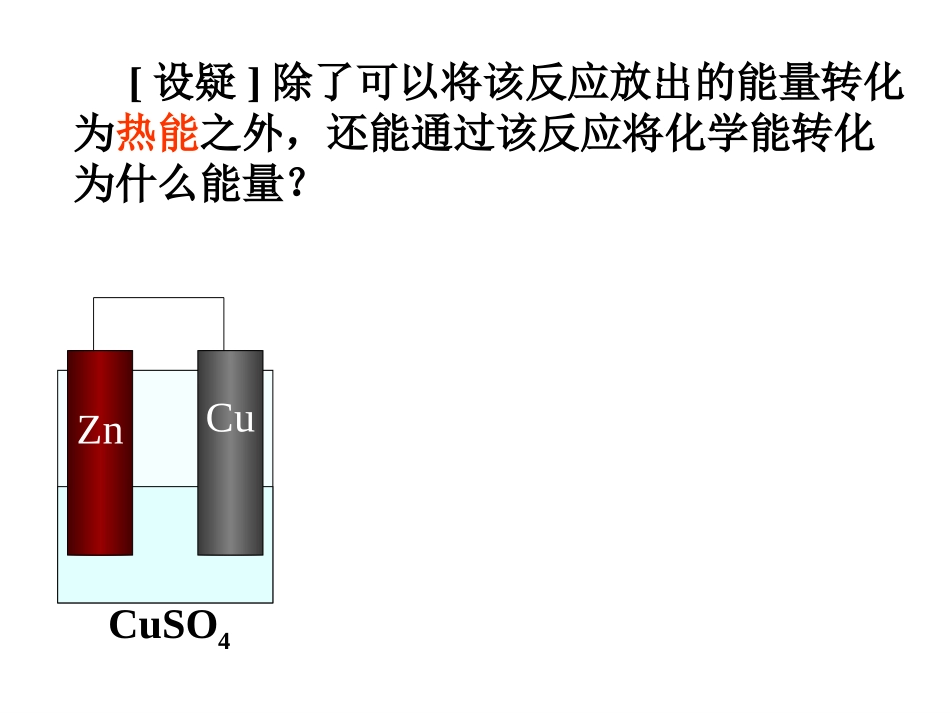
新课标人教版化学选修4第四章电化学基础第一节原电池ZnCuCuSO4[设疑]除了可以将该反应放出的能量转化为热能之外,还能通过该反应将化学能转化为什么能量?二、原电池的原理及形成条件[复习]1、原电池的定义:化学能转变为电能的装置。2、构成原电池的条件:(1)有两种活动性不同的金属(或金属与非金属)作电极。(2)电极材料均插入电解质溶液中。(3)两极相连形成闭合电路。两极-液-连线3、原电池的电极:①电极种类:②负极:还原剂发生氧化反应的一极;③正、负极的判断方法:电流计指针的偏转方向:电子流出或电流流入的一极为负极,电子流入或电流流出的一极为正极实验现象:电极本身溶解的为负极,电极上有金属或气体析出的为正极正极:氧化剂发生还原反应的一极;金属—金属(活泼性不同);金属—非金属;惰性材料作两极。ZnCuCuSO4•正极(铜电极):还原反应Cu2++2e-=Cu•负极(锌电极):氧化反应Zn-2e-=Zn2+电池反应:Zn+Cu2+=Cu+Zn2+(总反应)探究一:探究一:预测P预测P7171[[实验实验4-1]4-1]的的现象和结论现象和结论现象现象::锌片变细锌片变细,,铜上有红色物质析出铜上有红色物质析出,,电流计指针发生偏电流计指针发生偏转转..结论结论::化学能化学能电能电能Zn-2eZn-2e--=Zn=Zn2+2+Zn+Cu2+=Zn2++Cu2e2e--CuCu2+2++2e+2e--=Cu=Cu一、原电池的工作原理一、原电池的工作原理1.电路:外电路内电路电子流向:由失电子的一极向得电子的一极电流方向:与电子流向相反阴离子流向与电子流向一致阳离子流向与电流一致2.电极:负极:电子流出的一极正极:电子流入的一极3.电极反应式:负极(氧化反应):Zn-2e-=Zn2+正极(还原反应):CuCu2+2++2e+2e--=Cu=Cu4.总反应式(氧化还原反应):Zn+Cu2+=Zn2++Cu盐桥:在U型管中装满用饱和KCl溶液的琼脂。思考:1、盐桥的作用是什么?(1)使整个装置构成通路,代替两溶液直接接触。(2)平衡电荷思考:2、此电池的优点?此电池的优点:能产生持续、稳定的电流。一、盐桥原电池的工作原理1、构造特点:由两个半电池组成,每个半电池中的电极与电解质溶液互不反应,电池反应的还原剂与氧化剂分别位于两个半电池中,中间通过盐桥连接形成闭合回路。2、电极反应:负极(Zn):Zn-2e-=Zn2+(氧化反应)正极(Cu):Cu2++2e-=Cu(还原反应)电池反应:Zn+Cu2+=Zn2++Cu3、电子、电流的流向外电路:电子由负极(Zn片)流向正极(Cu片);电流由正极(Cu片)流向负极(Zn片);内电路:阳离子移向正极(Cu片);阴离子移向负极(Zn片)。4、盐桥的作用通过阴、阳离子的定向移动,在内电路形成电流回路而不中断电流。5、意义:随开随用,并能长时间产生持续、稳定的电流。[小结]1.关于原电池的叙述中正确的是()A.构成原电池两极的必须是两种不同金属B.内电路阳离子移向的一极为正极,外电路电子流出的一极为负极C.原电池工作中总是负极溶解,正极上有物质析出D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原2.判断下图装置,哪些能形成原电池()3.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是()A、C(s)+H2O(g)=CO(g)+H2(g)△H>0B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0C、4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H<0D、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<0BAECD