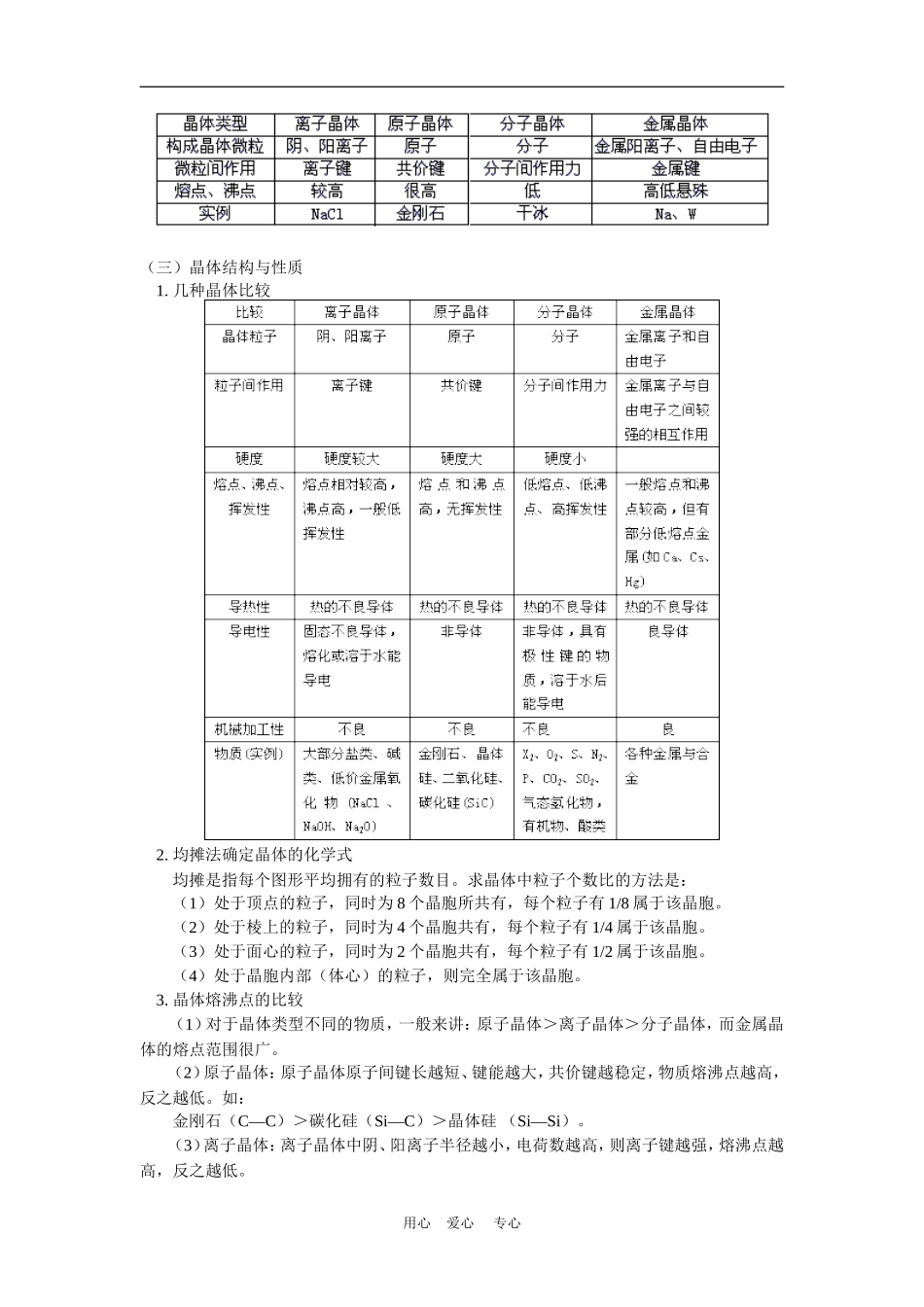
高三化学复习第三讲物质结构人教版【同步教育信息】一.本周教学内容:高三复习第三讲物质结构二.重点、难点:1.原子核与同位素、核外电子排布规律、原子结构与元素性质、原子和简单离子半径比较。2.化学键类型、分子结构。3.晶体类型、物理性质、简单计算。三.具体内容:(一)原子结构1.原子核与同位素原子简单离子中各种组成微粒的关系中性原子中,质量数(A)=质子数(Z)+中子数(N)=核外电子数+中子数(N)简单阳离子简单阳离子中,质子数(Z)=阳离子核外电子数+阳离子的电荷数。简单阴离子中,质子数(z)=阴离子的核外电子数—阴离子的电荷数2.同位素(1)同位素的概念:质子数相同,中子数不同的原子之间的互称。尽管同位素质量数不同,同位素原子的化学性质相同,由同位素的不同原子构成的单质的化学性质相同,由同位素的不同原子与其它不同元素构成的组成相同的化合物的化学性质相同。(2)元素的原子量是该种元素的各种同位素原子量的加权平均值,记为其中A、B……分别为各同位素的(相对)原子量,a%、b%……分别为各同位素在自然界中的原子子数百分比。如果用各种同位素的质量数代替上式中的原子量,所得值则是该元素的近似(平均)原子量。3.核外电子排布规律原子核外电子的排布必须遵守核外电子排布规律:首先电子排布时,应尽可能光占据离核较近的能量较低的级的轨道。此外,还应遵循下列规则:每个电子层最多容纳2n2个电子。最外层不超过8个电子(K层为最外层时,不超过2个电子)次外层不超过18个电子,倒数第三层不超过32个电子。4.原子结构与元素性质结构决定性质,因此原子结构决定该原子所属元素的性质:最外层电子数少于4个或最外层电子数小于电子层数,一般为金属元素,最外层电子数大于4个或最外层电子数大于电子层数,一般为非金属元素,最外层为8电子结构是相对稳定结构(K层为最外层时是2个电子)。5.原子和简单离子半径比较原子和简单离子半径大小的比较,决定于核内质子数(核电荷数)与核外电子数两方面因素,一般规律是:用心爱心专心同种元素微粒(原子或离子)半径比较,核外电子数越多,微粒半径越大,阴离子大于原子,大于低价阳离子,大于高价阳离子,电子层结构相同时,核电荷数越大,微粒半径越小。离子电荷数相同时,电子层数越多,离子半径越大。(二)化学键分子结构1.比较四种化学键2.微粒的空间构型如何确定(1)ABn型分子的(n>1)①原理:在分子中中心原子A周围的价电子对相距越远,键角越大,斥力越小,分子越稳定。由此可得出价电子对与构型的关系:(2)当中心原子存在孤对电子时,由于它“肥大”,占据较大空间,对成键电子对挤压,使键角变小。(3)比较为几种晶体类型用心爱心专心(三)晶体结构与性质1.几种晶体比较2.均摊法确定晶体的化学式均摊是指每个图形平均拥有的粒子数目。求晶体中粒子个数比的方法是:(1)处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞。(2)处于棱上的粒子,同时为4个晶胞共有,每个粒子有1/4属于该晶胞。(3)处于面心的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞。(4)处于晶胞内部(体心)的粒子,则完全属于该晶胞。3.晶体熔沸点的比较(1)对于晶体类型不同的物质,一般来讲:原子晶体>离子晶体>分子晶体,而金属晶体的熔点范围很广。(2)原子晶体:原子晶体原子间键长越短、键能越大,共价键越稳定,物质熔沸点越高,反之越低。如:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。(3)离子晶体:离子晶体中阴、阳离子半径越小,电荷数越高,则离子键越强,熔沸点越高,反之越低。用心爱心专心如KF>KCl>KBr>KI,CaO>KCl。(4)金属晶体:金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。如:Na<Mg<Al。合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。(5)分子晶体:分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高)如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3。①组成和结构相似的分...