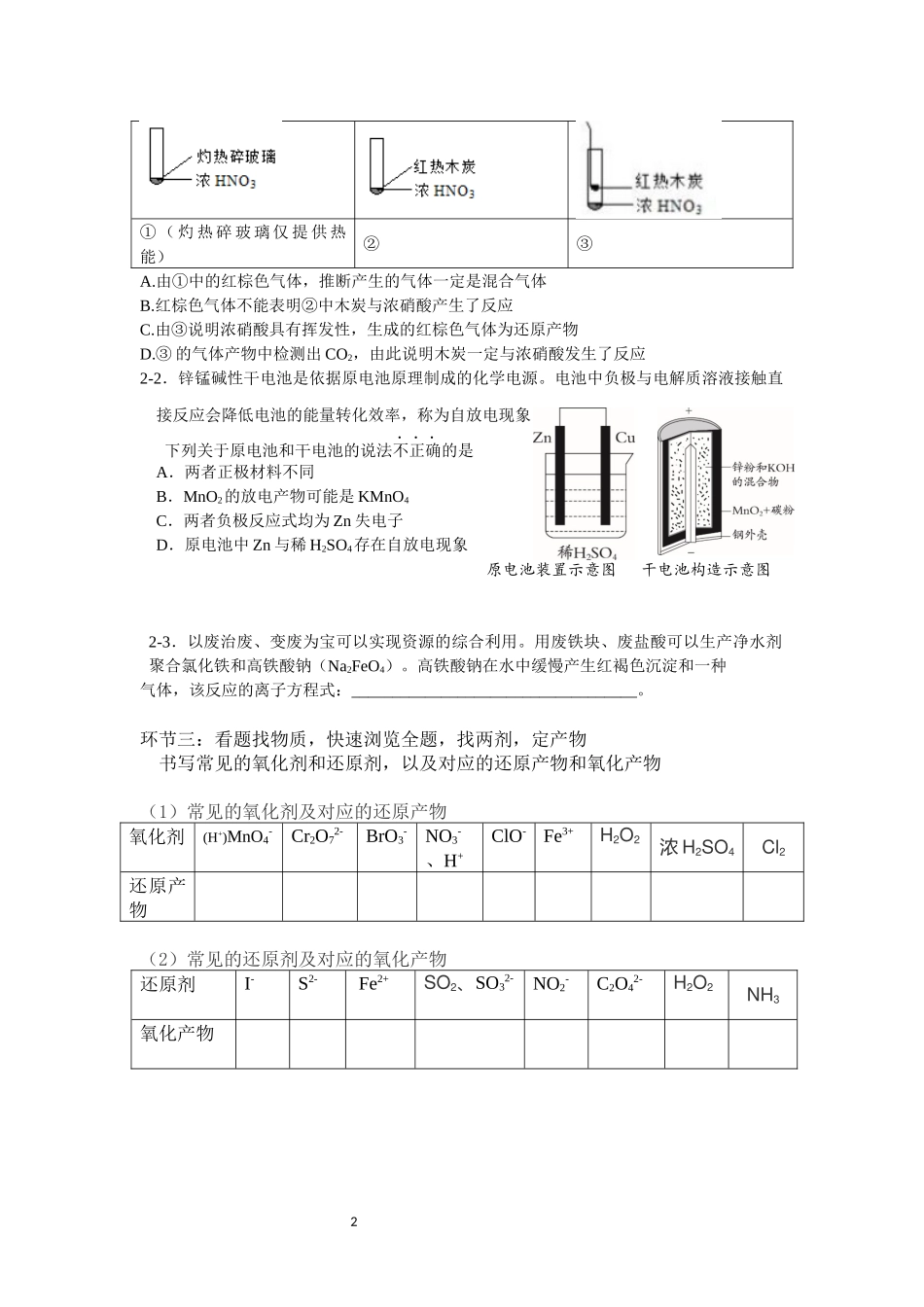
1“氧化还原”专题复习学案——针对学生的障碍点进行突破环节一:标识下列物质核心元素的化合价Cr2O3Cr2O72-CrO42-S2O32-FeO42-Fe3O4MnO42-MnO4-C2O42-NH3CN-OCN-SOCl2N2H4CH4CH3OHCH3CH2OHCH3CHOCH3COOH1-1.我国工业废水排放是有严格规定的。下列说法不正确的是A.废水中的Hg2+、Cd2+、Pb2+是重金属离子B.对于pH>9的废水可用中和法处理C.将CrO42-转化为Cr2O72-是用氧化还原的方法D.在含有Hg2+的废水中加入Na2S,可使Hg2+转变成沉淀而除去1-2.处理含氰(CN-)废水涉及以下反应,其中无毒的OCN-中碳元素为+4价。CN-+OH-+Cl2→OCN-+Cl-+H2O(未配平)···········反应I2OCN-+4OH-+3Cl2=2CO2+N2+6Cl-+2H2O···········反应II下列说法正确的是A.反应I中碳元素被还原B.反应II中CO2为氧化产物C.处理过程中,每产生1molN2,消耗3molCl2D.反应I中CN-与Cl2按物质的量之比1︰1进行反应1-3.含氮、磷污水过量排放引起的水体富营养化是当前备受关注的环境问题。氮的化合物在水中被细菌分解,当氧气不充足时,在反硝化细菌的作用下,细菌利用有机物(又称碳源,如甲醇)作为电子供体,将硝态氮的化合物(含NO3-)连续还原最终生成N2,发生反硝化作用,完成下述反应的方程式:+5CH3OH↑+CO32-+4HCO3-+环节二:氧化还原反应“有升必有降”书写氧还方程式的基本构成,并用双线桥法表示得失电子和化合价变化。2-1.下述实验中均有红棕色气体产生,对比分析所的结论不正确的是氧化剂+还原剂==还原产物+氧化产物2①(灼热碎玻璃仅提供热能)②③A.由①中的红棕色气体,推断产生的气体一定是混合气体B.红棕色气体不能表明②中木炭与浓硝酸产生了反应C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应2-2.锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。下列关于原电池和干电池的说法不正确的是A.两者正极材料不同B.MnO2的放电产物可能是KMnO4C.两者负极反应式均为Zn失电子D.原电池中Zn与稀H2SO4存在自放电现象原电池装置示意图干电池构造示意图2-3.以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠(Na2FeO4)。高铁酸钠在水中缓慢产生红褐色沉淀和一种气体,该反应的离子方程式:___________________________________。环节三:看题找物质,快速浏览全题,找两剂,定产物书写常见的氧化剂和还原剂,以及对应的还原产物和氧化产物(1)常见的氧化剂及对应的还原产物氧化剂(H+)MnO4-Cr2O72-BrO3-NO3-、H+ClO-Fe3+H2O2浓H2SO4Cl2还原产物(2)常见的还原剂及对应的氧化产物还原剂I-S2-Fe2+SO2、SO32-NO2-C2O42-H2O2NH3氧化产物3吸收塔中和池纯碱……沉淀,加热灼烧得Cr2O3产品含SO2的硫酸厂烟气3-1.碘摄入过多或者过少都会增加患甲状腺疾病的风险。目前国家标准(GB/T13025.7)所用的食盐中碘含量测定方法:①用饱和溴水将碘盐中少量的I-氧化成IO3-。②再加入甲酸发生反应:Br2+HCOOH===CO2↑+2HBr。③在酸性条件下,加入过量KI,使之与IO3-完全反应。④以淀粉作指示剂,用Na2S2O3标准溶液进行滴定,测定碘元素的含量。I2+2Na2S2O3===2NaI+Na2S4O6①中反应的离子方程式为________________________________________。③中反应的离子方程式为________________________________________。3-2.以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,将废铁块进行预处理制成电极,通过电解制备高铁酸钠,该装置原理示意图如右。铁块做_______(填“阳极”或“阴极”),对应的电极反应式为___________________________________。3-3.某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下:①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为。3-4.某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。滤渣1中加入硫酸并通入氧气可...