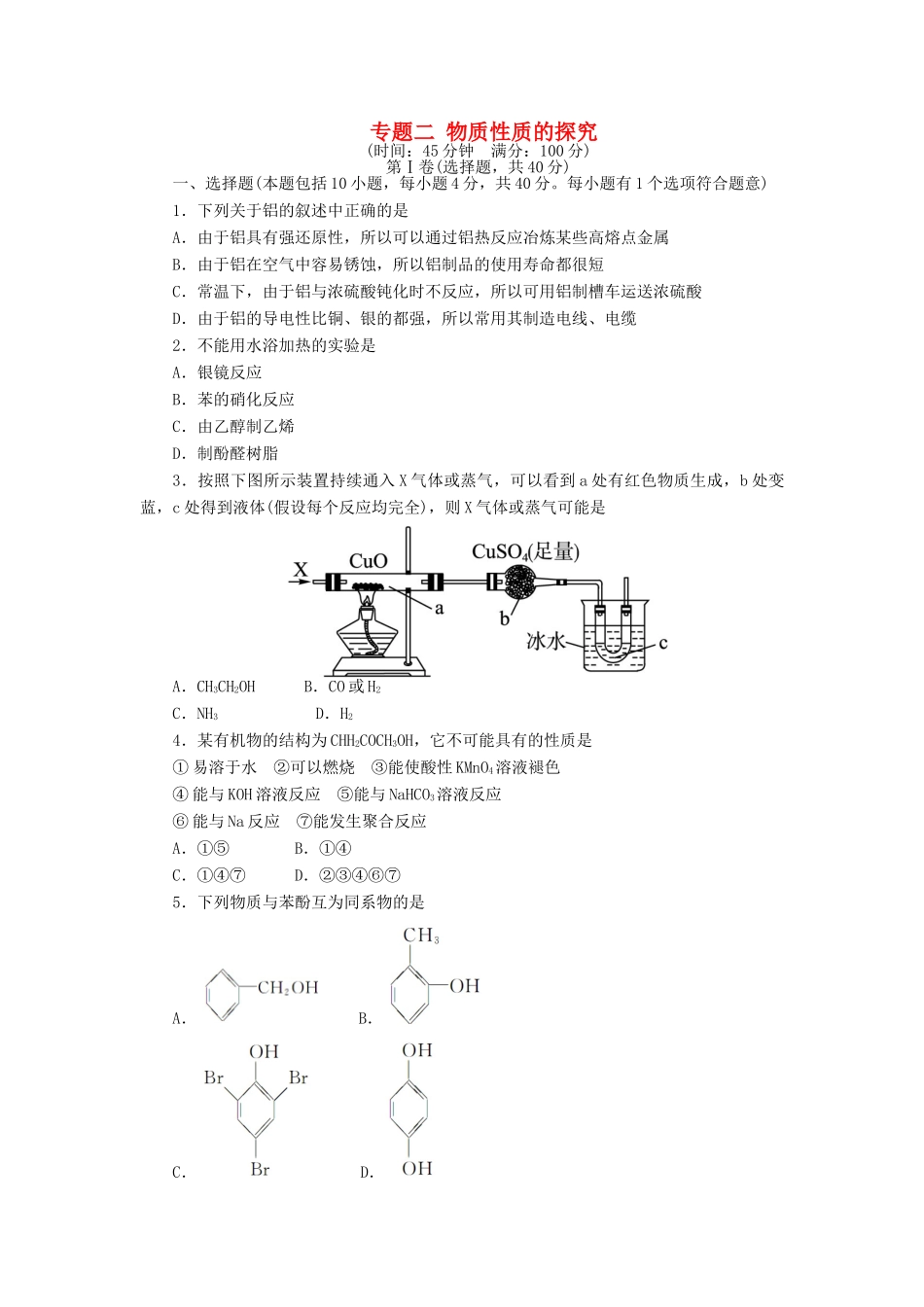
专题二物质性质的探究(时间:45分钟满分:100分)第Ⅰ卷(选择题,共40分)一、选择题(本题包括10小题,每小题4分,共40分。每小题有1个选项符合题意)1.下列关于铝的叙述中正确的是A.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属B.由于铝在空气中容易锈蚀,所以铝制品的使用寿命都很短C.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸D.由于铝的导电性比铜、银的都强,所以常用其制造电线、电缆2.不能用水浴加热的实验是A.银镜反应B.苯的硝化反应C.由乙醇制乙烯D.制酚醛树脂3.按照下图所示装置持续通入X气体或蒸气,可以看到a处有红色物质生成,b处变蓝,c处得到液体(假设每个反应均完全),则X气体或蒸气可能是A.CH3CH2OHB.CO或H2C.NH3D.H24.某有机物的结构为CHH2COCH3OH,它不可能具有的性质是①易溶于水②可以燃烧③能使酸性KMnO4溶液褪色④能与KOH溶液反应⑤能与NaHCO3溶液反应⑥能与Na反应⑦能发生聚合反应A.①⑤B.①④C.①④⑦D.②③④⑥⑦5.下列物质与苯酚互为同系物的是A.B.C.D.6.下列物质久置于空气中,颜色发生变化的是A.Na2SO3B.苯酚C.Na2CO3D.CaO7.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案。方案Ⅰ:铜铝混合物测定生成气体的体积方案Ⅱ:铜铝混合物测定剩余固体的质量下列有关判断中不正确的是A.溶液A和B均可以是盐酸或NaOH溶液B.若溶液B选用浓硝酸,则测得铜的质量分数偏小C.溶液A和B均可选用稀硝酸D.实验室中方案Ⅱ更便于实施8.最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是A.铝的金属性比镓强B.铝的熔点比镓低C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应D.铝、镓合金与水反应后的物质可以回收利用冶炼铝9.一种兴奋剂X的结构如下图所示。下列说法中不正确的是A.1molX与足量的NaOH溶液反应,最多消耗3molNaOHB.1molX与足量浓溴水反应,最多消耗3molBr2C.X遇FeCl3溶液显色,可看作酚类物质D.兴奋剂X中所有碳原子有可能共平面10.为达到预期的实验目的,下列操作正确的是A.向无色溶液中加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有B.用pH试纸测定氯水的pHC.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸D.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量第Ⅱ卷(非选择题,共60分)二、非选择题(本题包括4小题,共60分)11.(16分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度的H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol·L-1的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示。请填空回答:(1)H2SO4溶液的物质的量浓度为________;(2)a=2.3,用于沉淀铁离子,消耗NaOH溶液的体积是______,铝土矿中各组成成分的质量分数分别为:Al2O3_________,Fe2O3_________,SiO2_________。(3)a值的范围应是________,在这个范围内,a值越大,______的质量分数越小。12.(15分)某化学实验小组对“铝热反应”实验现象的描述是:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe2O3、Al2O3、Fe的熔点、沸点数据如下:物质AlFe2O3Al2O3Fe熔点/℃660146220541535沸点/℃2467—29802750(1)某同学猜测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁的低,此时,液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?__________(填“合理”或“不合理”)。(2)根据已有知识找出一个验证产物中有Fe的最简单方法:________________________。(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。请填写下列表格:所用试剂实验操作及现象有关反应的化学方程式13.(1...