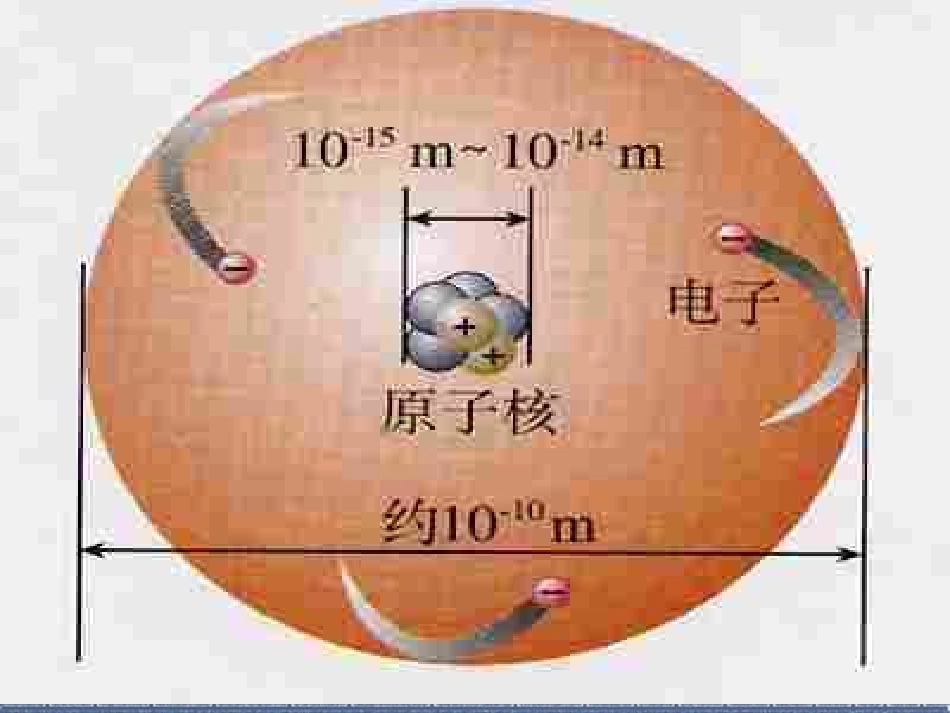
第三单元物质构成的奥秘课题2原子的构成是保持物质化学性质的最小粒子,是化学变化中的最小粒子。水的电解:分析动画,归纳信息。水氧气+氢气H2OO2+H2分子通电水分子氢气分子氧气分子氢原子氧原子通电原子英国物理学家卢瑟福英国物理学家卢瑟福αα粒子散射实验粒子散射实验铝箔由很多很多的铝原子构成,实验证明:大部分α粒子能穿过铝箔;少数的α粒子方向发生大角度改变。为什么?原子是不是简单而不可分割的实心球体?他由哪些部分构成?一、原子的构成一、原子的构成在化学变化中分子可以再分,而原子不能再分。那么,原子究竟是不是简单而不可分割的实心球体呢?你能猜想原子的内部结构吗?1个质子带一个单位正电荷;1个电子带一个单位负电荷。中子不带电;原子的构成小结:原子(带正电)(不显电性)(带负电)(一个质子带一个单位正电荷)(不带电)核外电子原子核质子中子核电荷数就是原子核所带的正电荷数碳原子(C—12)结构动画+-电子---电子中子质子原子核原子原子核核外电子中子质子(不带电)6+6+6-+++++原子核你想知道原子和原子核究竟有多大吗?原子与乒乓球体积比相当于乒乓球与地球的体积之比。原子核(蚂蚁)原子(体育场)原子核比原子小得多原子种类质子数中子数核外电子数氢101碳666氧888钠111211氯171817观察表格,思考下列问题2、所有原子都是由质子、中子、电子构成的吗?3、质子、中子、电子在数量上有什么关系?1、不同种原子之间有哪些区别?4、原子本身带电吗?为什么?不同原子的质子数、中子、电子数都不同。氢原子的中子数为0,因此,不是所有的原子都有中子。质子数一定等于电子数,但不一定等于中子数。原子核所带的正电荷数和核外电子所带的负电荷数,电量相等、电性相反,所以原子不带电。在原子中:核电荷数=质子数=核外电子数【【思考思考】】电子在核外的空间里做高速的运动,它们会电子在核外的空间里做高速的运动,它们会相互碰撞打架吗?电子在核外的排布会有什么特点?相互碰撞打架吗?电子在核外的排布会有什么特点?特点:核外电子特点:核外电子是分层运动的,是分层运动的,这种分层运动也这种分层运动也叫叫分层排布分层排布二、核外电子的排布:二、核外电子的排布:二、核外电子的排布:二、核外电子的排布:1、核外电子排布特点:(1)、各层最多能容纳的电子数为2n2个;(2)、最外层不超过8个(除第一层不超过2个);(3)、能量低的优先排满,依次再排能量逐步升高的电子层里。【【思考思考】】能否用一个更简明的图形来表示原子的结构及原子能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点呢?核外电子的排布特点呢?22、原子结构示意图及各部分表示的含义:、原子结构示意图及各部分表示的含义:电子层每个电子层上的电子数核内质子数原子核【思考】:下列1-18元素原子结构示意图中,有什么特点?+22氦(He)+1028氖(Ne)氩(Ar)+12282镁(Mg)+13283铝(Al)+624碳(C)+725氮(N)+826氧(O)+927氟(F)+18288++1128钠(Na)13、各类元素原子的最外层电子结构特征:(1)稀有气体元素:最外层8个电子(除氦2个),称为稳定结构。(2)金属元素:最外层电子数一般少于4个。(3)非金属元素:最外层电子数一般大于或等于4。+11-----------+17-----------------钠原子氯原子质子数=电子数=11质子数=电子数=17不带电不带电NaCl+11-----------+17-----------------钠原子氯原子+11-----------+17-----------------钠原子氯原子+11-----------+17-----------------钠原子氯原子+11----------+17------------------钠原子氯原子+11----------+17------------------我稳定了我也稳定了,谢谢!钠离子氯离子质子数=电子数=质子数=电子数=11101718><带一个单位正电荷带一个单位负电荷Na+Cl-+11----------+17------------------NaCl静电作用形成氯化钠NaClNaCl钠钠++氯气氯化钠氯气氯化钠点燃点燃NaClNaClNaNaClCl22钠在氯气中点氯气中点燃生成氯化钠燃生成氯化钠的形成过程:的形成过程:三、离子的形成1、离子带电的原子2、离子分类阴离子阳离子3、离子的表示——离子符号(电子数>质子数)(电子数<质子...