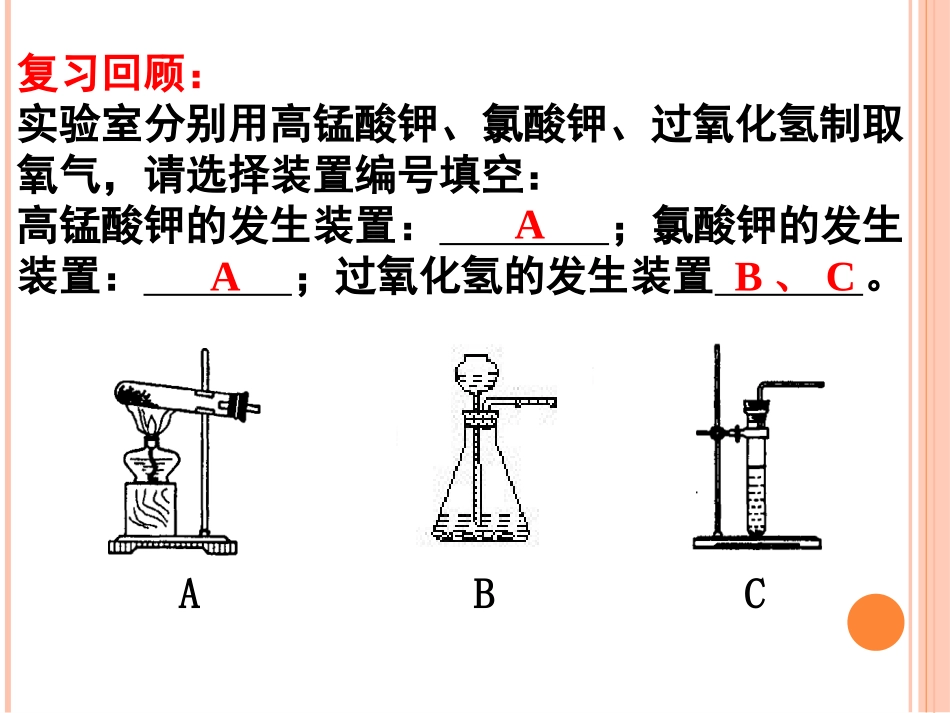
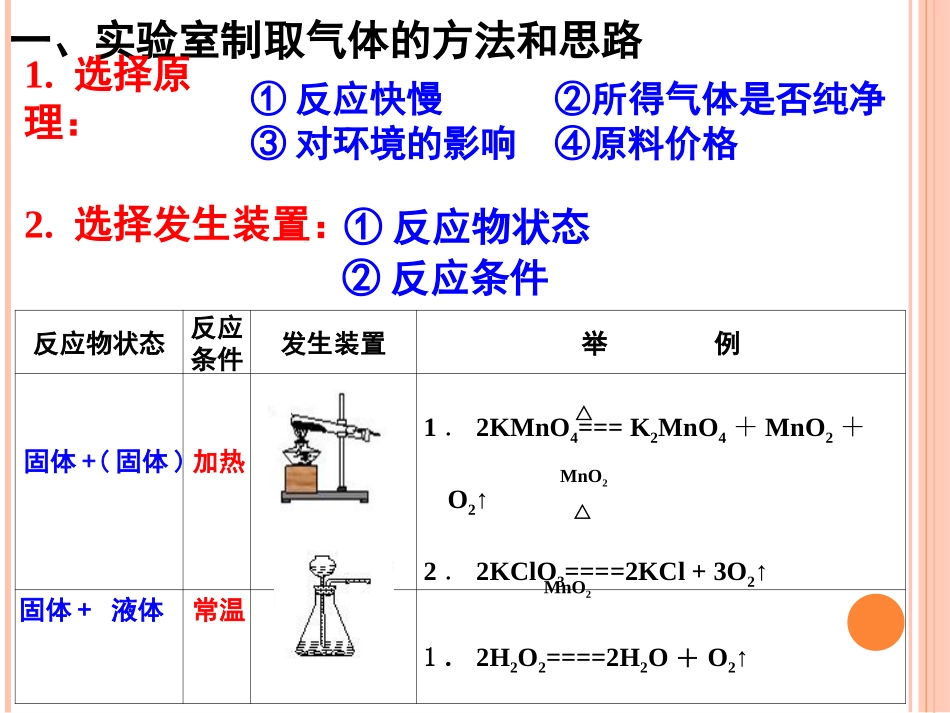
复习回顾:实验室分别用高锰酸钾、氯酸钾、过氧化氢制取氧气,请选择装置编号填空:高锰酸钾的发生装置:;氯酸钾的发生装置:;过氧化氢的发生装置。AAABCB、C反应物状态反应条件发生装置举例1.2KMnO4===K2MnO4+MnO2+O2↑2.2KClO3====2KCl+3O2↑1.2H2O2====2H2O+O2↑一、实验室制取气体的方法和思路1.选择原理:①反应快慢②所得气体是否纯净③对环境的影响④原料价格2.选择发生装置:①反应物状态△△MnO2MnO2②反应条件固体+(固体)固体+液体加热常温3.选择收集装置:⑵排空气法:⑴排水集气法:①向上排空气法:②向下排空气法:ρ气体>ρ空气ρ气体<ρ空气不易(或难)溶于水,不与水反应注意:①空气的平均相对分子质量为29。②密度与空气相近的气体一般不能用排空气法。5.验满方法②排空气法:6.气体存放①ρ气体>ρ空气:②ρ气体<ρ空气:(收集较纯净的气体)①排水法:4.气体检验方法(气体的化学性质)不需验满。利用气体的化学性质检验,注意实验位置应在集气瓶口。用玻璃片盖住正放用玻璃片盖住倒放二、二氧化碳的实验制法1.常用药品:大理石(或石灰石)、稀盐酸反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑2.发生装置:固体和液体常温反应制气体的装置3.收集装置:只能用向上排空气法4.气体检验:5.验满:用燃着的木条放在集气瓶口,若木条熄灭,则证明已满,反之则没满。6.气体存放:ρCO2>ρ空气:用玻璃片盖住正放澄清石灰水变浑浊CO2制得的气体不纯制取条件不便反应太快,不利于收集①①木炭在氧气中燃烧生成二氧化碳木炭在氧气中燃烧生成二氧化碳②②木炭还原氧化铜,生成铜和二氧化碳木炭还原氧化铜,生成铜和二氧化碳⑤⑤石灰石与稀盐酸在常温下反应石灰石与稀盐酸在常温下反应C+O2====CO2点燃C+2CuO====2Cu+CO2↑高温CaCO3+2HCl===CaCl2+H2O+CO2↑③③碳酸钠与盐酸反应碳酸钠与盐酸反应Na2CO3+2HCl===2NaCl+H2O+CO2↑④④石灰石与稀硫酸在常温下反应石灰石与稀硫酸在常温下反应CaCO3+H2SO4===CaSO4+H2O+CO2↑反应生成的硫酸钙微溶于水,覆盖在石灰石表面,阻止反应的进行1、药品的选择:三、实验室制取二氧化碳的注意事项:注意事项:①长颈漏斗必须液封②导管应在橡皮塞下少许③导管应接近集气瓶底部(防止气体从长颈漏斗口逸出)①②③2、组装装置: