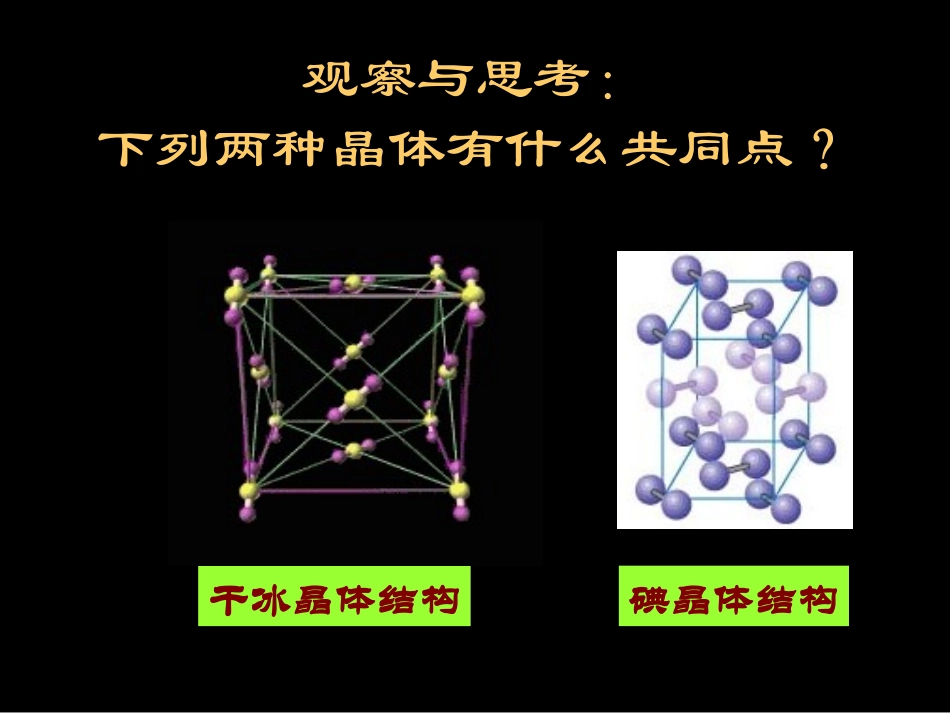
22分分分分分分分分分分分分分分分分分分交流交流··讨论讨论雪花、冰糖、食盐、水晶和电木(酚醛树脂)这些固体是否属于晶体?若不是晶体,请说明理由。观察与思考:观察与思考:下列两种晶体有什么共同点?下列两种晶体有什么共同点?碘晶体结构干冰晶体结构一、分子晶体构成晶体的粒子是分子,以分子间作用力(范德华力,氢键)相互作用的晶体叫分子晶体。1、概念(1)所有非金属氢化物:H2O,H2S,NH3,CH4,HX(2)部分非金属单质:X2,O2,H2,S8,P4,C60(3)部分非金属氧化物:CO2,SO2,NO2,P4O6,P4O10(4)几乎所有的酸:H2SO4,HNO3,H3PO4(5)绝大多数有机物的晶体:乙醇,冰醋酸,蔗糖2、典型的分子晶体:分子晶体有哪些物理特性,为什么?分子晶体有哪些物理特性,为什么?(1)(1)较低的熔点和沸点,易升华;较低的熔点和沸点,易升华;(2)(2)较小的硬度;较小的硬度;(3)(3)一般都是绝缘体,熔融状态也不导电。一般都是绝缘体,熔融状态也不导电。原因:分子间作用力较弱原因:分子间作用力较弱33、物理特性:、物理特性:分子的密堆积分子的密堆积(与每个分子距离最近的相同分子共有(与每个分子距离最近的相同分子共有1212个)个)氧(O2)的晶体结构碳60的晶胞分子的密堆积分子的密堆积(与(与COCO22分子距离最近分子距离最近的的COCO22分子共有个)分子共有个)干冰的晶体结构图1212冰中1个水分子周围有4个水分子冰中1个水分子周围有4个水分子冰的结构冰的结构氢键具有方向性氢键具有方向性分子的非密堆积分子的非密堆积只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰、I2、O2。4、分子晶体结构特征(1)密堆积有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF、NH3、冰(每个水分子周围只有4个紧邻的水分子)。(2)非密堆积笼状化合物科学视野天然气水合物——一种潜在的能源思考与交流思考与交流•CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。•碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?180º109º28´SiO共价键二氧化硅晶体结构示意图109º28´共价键金刚石的晶体结构示意图金刚石的晶体结构示意图二.原子晶体(共价晶体)构成晶体的粒子是原子,所有的相邻原子间都以共价键相结合而形成空间立体网状结构的晶体。金刚金刚石石1、概念:观察·思考•对比分子晶体和原子晶体的数据,原子晶体有何物理特性?2、原子晶体的物理特性(1)熔点和沸点高;(2)硬度大;(3)一般不导电;(4)且难溶于一些常见的溶剂。在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体有特殊的物理性质。3、常见的原子晶体(1)某些非金属单质:●金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体锗(Ge)等(2)某些非金属化合物:●碳化硅(SiC)晶体、氮化硼(BN)晶体(3)某些氧化物:●二氧化硅(SiO2)晶体、α-Al2O3解释:结构相似的原子晶体,原子半径越小,键长越短,键能越大。碳、硅、锗原子半径依次增大,键长依次增大,键的强度依次减弱。故它们熔点和硬度依次下降。即金刚石>硅>锗学与问1、怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度依次下降?2、“具有共价键的晶体叫做原子晶体”。这种说法对吗?为什么?分子晶体、原子晶体结构与性质关系的比较晶体类型分子晶体原子晶体结构粒子间的作用力性质硬度溶、沸点导电溶解性构成晶体粒子分子原子分子间作用力共价键结构、性质较小较大较低很高固态和熔融状态都不导电一般不导电相似相溶难溶于常见溶剂知识拓展-比较石墨和金刚石晶体结构知识拓展-比较石墨和金刚石晶体结构1.55×10-10m石墨金刚石思考:(1)石墨为什么很软?(2)石墨的熔沸点为什么很高?石墨的熔点为什么高于金刚石?(3)石墨属于哪类晶体?为什么?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。它们都有很强的C-C共价键。在石墨中各层均为平面...