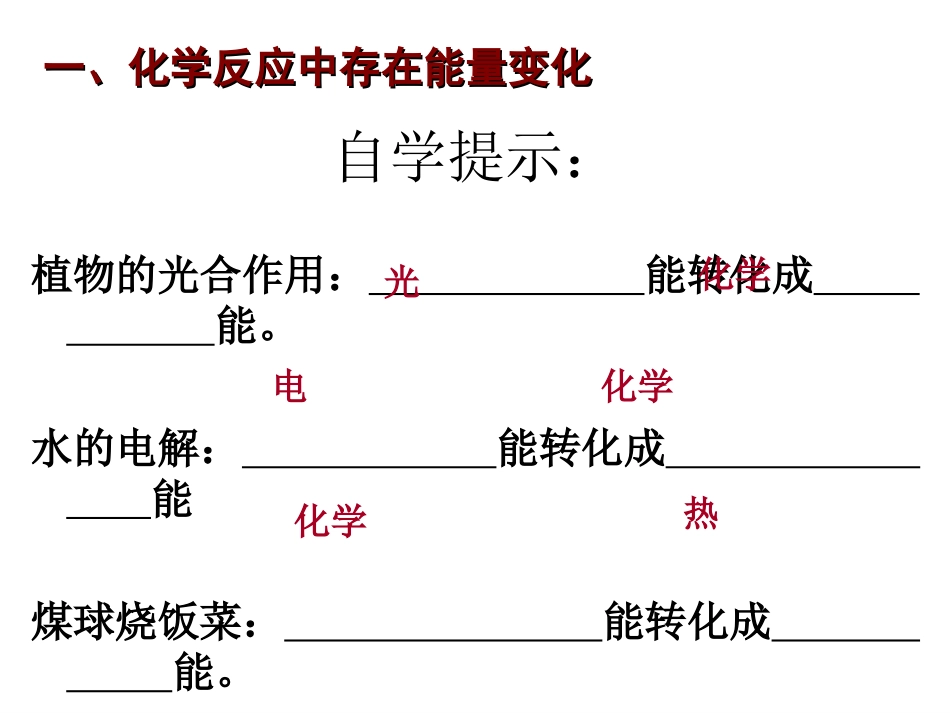
第二单元化学反应中的热量第二单元化学反应中的热量第一节化学反应中的热量变化第一节化学反应中的热量变化专题专题22:化学反应与能量转化:化学反应与能量转化自学提示:植物的光合作用:能转化成能。水的电解:能转化成能煤球烧饭菜:能转化成能。光化学化学电化学热一、化学反应中存在能量变化一、化学反应中存在能量变化实验实验现象现象结论结论[[实验实验1]1]:镁条与:镁条与盐酸反应,用手触盐酸反应,用手触摸试管,感受温度。摸试管,感受温度。[[实验实验2]2]:氯化铵:氯化铵固体与固体与Ba(OH)Ba(OH)22·8H·8H22OO反应,用手触摸反应,用手触摸塑料袋,感受温度。塑料袋,感受温度。活动与探究试管外壁试管外壁发热发热镁与盐酸反应镁与盐酸反应有热量放出有热量放出温度降低温度降低氢氧化钡晶氢氧化钡晶体与氯化铵体与氯化铵固体反应固体反应需需要吸收热量要吸收热量1.1.化学反应伴随化学反应伴随能量能量变化变化,,主要表现为主要表现为热量热量的放出或吸的放出或吸收收;;2.2.放出热量的化学反应叫做放出热量的化学反应叫做放热反应放热反应;;吸收热量的化学反应叫做吸收热量的化学反应叫做吸热反应吸热反应..1.1.实验观察到的现象说明什么问题?实验观察到的现象说明什么问题?2.2.从热能变化的角度分,化学反应有哪些类型?从热能变化的角度分,化学反应有哪些类型?思考:思考:回答:回答:二、化学反应中的热量变化二、化学反应中的热量变化根据你的生活经验和已学知识,判断下列反应是根据你的生活经验和已学知识,判断下列反应是放热反应还是吸热反应:放热反应还是吸热反应:(1)(1)镁条的燃烧。镁条的燃烧。(2)(2)高温锻炼石灰石。高温锻炼石灰石。(3)(3)氧化钙与水反应。氧化钙与水反应。(4)(4)盐酸和氢氧化钠溶液反应。盐酸和氢氧化钠溶液反应。课本课本PP3535交流和讨论交流和讨论放热吸热放热放热(1)金属与酸的反应、活泼金属与水的反应(2)所有的燃烧反应(3)酸碱中和反应(4)大多数化合反应(5)铝热反应常见的放热反应常见的吸热反应CaO与H2O的反应思考:放(吸)热反应与反应条件的关系。无关(1)氢氧化钡与氯化铵晶体的反应(2)大多数分解反应(3)C(s)+CO2(g)==2CO(g)(4)C(s)+H2O(g)==CO(g)+H2(g)高温高温CaCO3分解二、化学反应中的热量变化二、化学反应中的热量变化化学反应中为什么会伴随着能量变化?物质发生化学变化的实质:就是旧的化学键断裂和新的化学键形成过程。断开化学键:吸收能量形成化学键:放出能量从微观角度分析:断开化学键所吸收的能量>形成化学键所放出的能量吸热反应断开化学键所吸收的能量<形成化学键所放出的能量放热反应三、化学反应中能量变化的原因三、化学反应中能量变化的原因问题解决已知:断开1molH2中的H-H键需要吸收436.4kJ的能量,断开1molCl2中的Cl-Cl键需要吸收242.7kJ的能量,生成1molHCl中的H-Cl键需要放出431.8kJ的能量。试说明H2+Cl2=2HCl是吸热反应还是放热反应?通过计算回答:吸收热量(436.4+242.7)kJ放出热量:431.8kJ×2>放热反应吸热反应吸热反应放热反应放热反应吸收能量放出能量从宏观角度分析生成物反应物的总能量生成物的总能量能量能量生成物反应物图1生成物的总能量反应物反应物的总能量图2反应过程反应过程如何用化学用语如何用化学用语表示放热反应和吸热反应?表示放热反应和吸热反应?四、热化学方程式四、热化学方程式CaCOCaCO33(s)==CaO(s)+CO(s)==CaO(s)+CO22(g)△H=+178.5kJ/mol(g)△H=+178.5kJ/mol11、定义:、定义:表明反应所放出或吸收的热量的化表明反应所放出或吸收的热量的化学方程式学方程式1molCaCO1molCaCO33吸收吸收178.5kJ178.5kJ热量,完全分热量,完全分解生成解生成1molCaO1molCaO和和1molCO1molCO22气体。气体。事实事实探究探究含义含义表明反应中的物质变化表明反应中的物质变化表明反应中能量的变化表明反应中能量的变化22、意义:、意义:C(s)+OC(s)+O22(g)==CO(g)==CO22(g)△H=(g)△H=--393.5393.5kJmol•kJmol•--11观察以下热化学反应方程式,你发现了什么?2H2(g)+O2(g)==2H2O(g)△H=-483.6kJ/mol2H2(g)+O2(g)==2H2O(l)△H=-571.6kJ/mol结论:同种物...