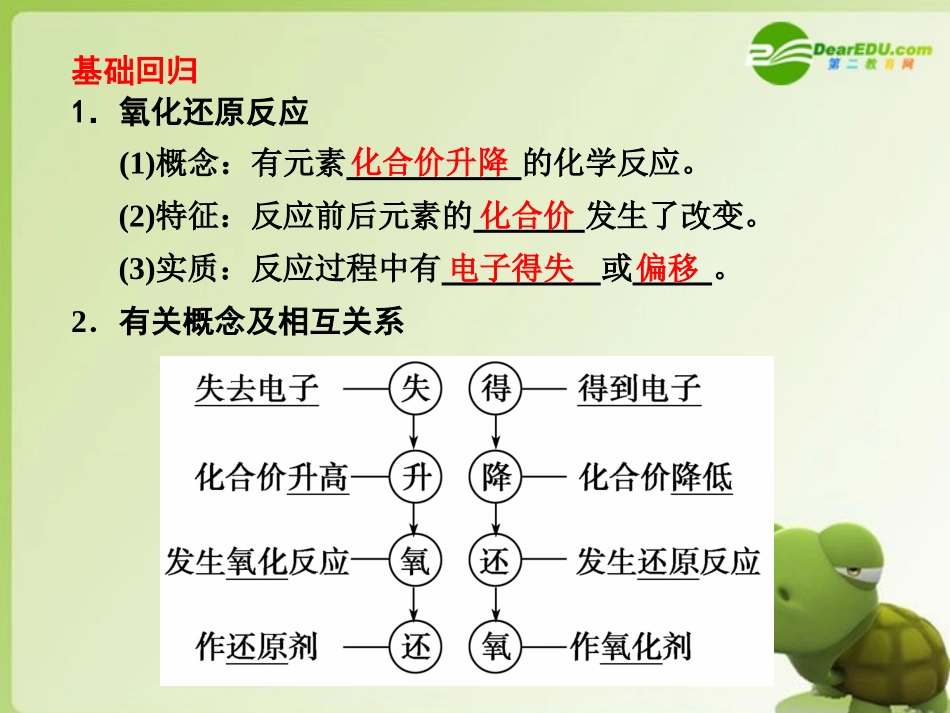
第一章化学反应及其能量变化第1讲氧化还原反应的基本概念基础盘点一、氧化还原反应的概念及判断自我诊断1.下列反应中属于化合反应的有__________,属于复分解反应的有__________,属于置换反应的有_____,属于氧化还原反应的有__________,氧化剂和还原剂是同一种物质的反应有__________,氧化产物和还原产物是同一种物质的反应有__________。①Zn+CuSO4===ZnSO4+Cu②2KMnO4+16HCl(稀)===2KCl+5Cl2↑+2MnCl2+8H2O③3O2=====放电2O3④Cl2+H2O===HCl+HClO⑤3NO2+H2O===2HNO3+NO⑥2CH3CH2OH+O22CH3CHO+2H2O⑦2FeCl2+Cl2===2FeCl3⑧CuSO4+Ba(OH)2===BaSO4↓+Cu(OH)2↓答案⑦⑧①①②④⑤⑥⑦④⑤⑦cu基础回归1.氧化还原反应(1)概念:有元素的化学反应。(2)特征:反应前后元素的发生了改变。(3)实质:反应过程中有或。2.有关概念及相互关系化合价升降化合价电子得失偏移3.氧化还原反应与四大反应类型之间的关系误区警示有单质参加或有单质生成的反应,不一定是氧化还原反应。如:同素异形体之间的转化。二、氧化还原反应中电子转移的方向和数目自我诊断2.下列标明电子转移的方向和数目的化学方程式中正确的是()答案C基础回归1.双线桥法用箭头表示氧化还原反应中同一元素的原子或离子得到或失去电子的结果。在线上标出“”或“”电子的数目,一条箭头线由指向__________,另一条由指向。如:氧化剂还原剂还原产物氧化产物得到失去氧化剂还原产物还原剂氧化产物2.单线桥法用箭头表示反应物中不同(或相同)原子或离子间的电子转移。在线上标出,箭头指出电子转移的方向,即箭头由指向。如:还原剂氧化剂转移电子总数还原剂氧化剂三、常见的氧化剂、还原剂自我诊断3.下列反应中,水作还原剂的是()A.2Na+2H2O===2NaOH+H2↑B.Cl2+H2O===HCl+HClOC.2F2+2H2O===4HF+O2D.SO2+H2O===H2SO3C解析A.H2O作氧化剂;B.H2O既不是氧化剂,又不是还原剂;D.非氧化还原反应。【基础回归】1.常见的氧化剂类别实例活泼非金属单质F2、Cl2\,O2\,O3元素处于高价态的氧化物MnO2\,Pb3O4元素处于高价态的含氧酸浓H2SO4、HNO3元素处于高价态的盐KClO4\,KMnO4\,K2Cr2O7、Fe3+盐过氧化物Na2O2\,H2O22.常见的还原剂类别实例活泼的金属单质Na、Mg、Al、Fe等某些非金属单质H2、C、Si元素处于低价态的氧化物CO、SO2元素处于低价态的酸H2S、H2SO3元素处于低价态的盐Fe2+盐3.氧化性和还原性(1)氧化性是指;还原性是指。(2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-Na+,Al-3e-Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。从元素的价态考虑:最高价态——只有氧化性,如Fe3+、H2SO4、KMnO4等;最低价态——只有还原性,如金属单质、Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe2+、S、Cl2等。得电子的性质(或能力)失电子的性质(或能力)要点一氧化还原反应的基本概念及其关系要点精讲氧化剂→得电子→化合价降低―→还原反应―→氧化性→还原产物反应物→反应本质→反应特征→发生反应类型→表现性质→生成物还原剂→失电子→化合价升高→氧化反应―→还原性―→氧化产物例如:易错点拨分析或判断化合价,一方面要记住常见元素的价态。如,一般H为+1,O为-2,除Fe为+2或+3外,Na、Mg、Al等多数金属无变价等。另一方面要利用物质的电中性原则进行推断。如KMnO4中Mn的价态为:2×4-1=7,即+7价。Cr2O中Cr的价态为:2×7-22=6即+6价。另外,个别非金属元素的化合物中元素的价态是正还是负,取决于非金属性的相对强弱。如Si3N4中Si显+4价,N显-3价。27典例导析1制备氰氨基化钙的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑,在反应中()A.氢元素被氧化,碳元素被还原B.HCN是氧化剂,CaCO3是还原剂C.CaCN2是氧化产物,H2是还原产物D.CO为氧化产物,H2为还原产物解析该题的最关键一点是分析各元素的化合价,难点是碳元素在HCN和CaCN2中的化合价,从反应物CaCO3到生成物CO2,碳的化合价均为+4价,没有改变,再从生成物H2分析发现氢的化合价降低,显然HCN中氢得电子...