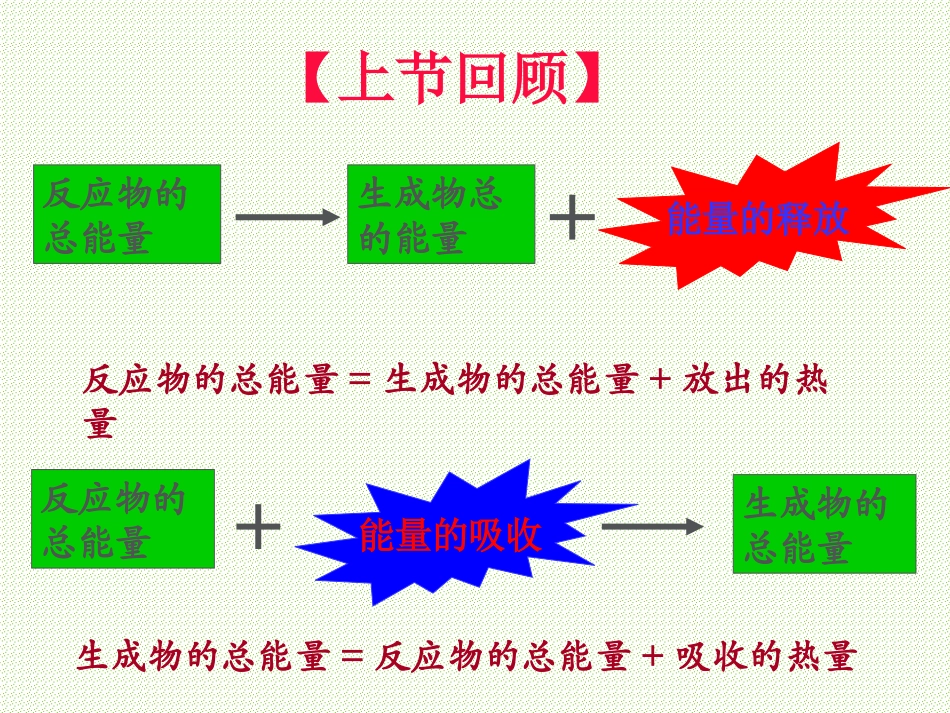
第二章化学反应与能量第一节第2课时化学能与热能的相互转化【上节回顾】化学键与化学反应中能量变化的关系:放热反应:反应物的总键能小于生成物的总键能吸热反应:反应物的总键能大于生成物的总键能反应物的总能量生成物总的能量能量的释放反应物的总能量生成物的总能量能量的吸收反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量【上节回顾】二、化学能与热能的相互转化化学反应中的能量变化,通常表现为热量的变化——吸热或放热。实验2-1现象结论铝片与盐酸反应,放出大量气泡,温度升高该反应是放热反应铝片与盐酸的反应:实验2-2Ba(OH)2·8H2O与NH4Cl固体混合现象结论1、玻璃片会与小烧杯粘结在一起2、有少许刺激性气味气体产生3、反应物成糊状该反应是放热反应,反应中有NH3、水生成Ba(OH)2·8H2O+2NH4Cl=10H2O+2NH3↑+BaCl2反应方程式:实验2-3盐酸温度(℃)NaOH溶液温度(℃)中和反应后温度(℃)结论:中和反应是放热反应。330C240C酸碱中和反应240C1、中和热:在稀溶液中,强酸和强碱的发生中和反应生成1molH2O(液态)所释放的热量。如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?思考与交流实验:NaOH溶液与盐酸反应的中和热的测定公式:Q=cm△T测量数据:1、NaOH与盐酸反应的总质量2、反应前后的温度变化实验成败关键:防止反应过程中热量的散失⑴使用碎泡沫塑料填充在大烧杯周围,增强保温、隔热效果,以减小实验过程中热量的损失。⑵使用环形玻璃搅拌棒,不断搅动,使热量分布均匀。测量中和反应热应该注意哪些问题?1、保温隔热的效果一定要好。2、酸碱浓度要准确。3、温度计要读准,水银球要全浸在4、实验操作时动作要快,以尽量减溶液中,且要稳定一段时间再读。少热量的散失。实验2-35、多做几次,取平均值几种典型的放热和吸热反应常见的放热反应:燃烧、金属和酸反应、酸碱中和反应、大多数的化合反应(如生石灰与水反应)、物质的缓慢氧化。常见的吸热反应:大多数的分解反应以H2、CO、C为还原剂的氧化还原反应晶体Ba(OH)2·8H2O与NH4Cl1、判断:(1)需加热的反应一定是吸热反应(2)不需要加热的反应一定是放热反应(3)一个反应是吸热还是放热与反应的条件没有直接联系,与反应物及生成物的总能量的相对大小有关。(4)可逆反应若正向放热,则逆向一定吸热2、下列说法不正确的是()A化学反应除了生成新物质外,还伴随着能量的变化B物质燃烧和中和反应均放出热量C分解反应肯定是吸热反应D化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量的相对大小C3、下列化学反应的热量变化可用:H+(aq)+OH—(aq)=H2O(l)表示,反应的中和热为57.2kJ/mol,下列哪个反应可说明()A.含有1molH2SO4的浓硫酸与含有1molNaOH的稀溶液混合B、1mol/L的盐酸与1mol/L的NaOH混合生成1mol水C.0.1mol/L的醋酸溶液与1mol/L的NaOH溶液等体积混合D.1mol/L的盐酸与1mol/L的氨水混合生成1mol水B谢谢!