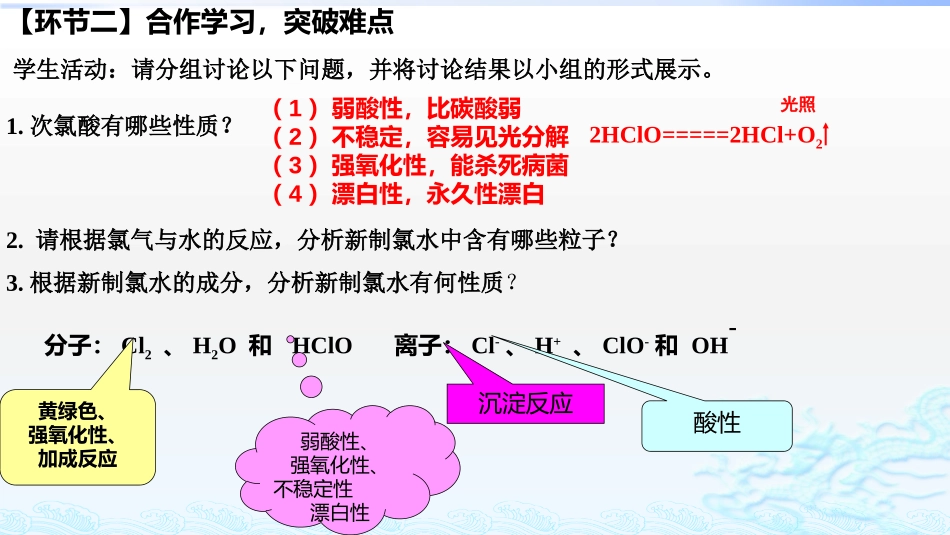
阎良区关山中学王媛学习目标:1.能说出氯气的物理性质;列举氯气在生活生产中的应用。2.能根据氯气的性质,正确书写相关反应的化学方程式。3.能正确选择制备纯净、干燥氯气的实验仪器及试剂,使学生通过对比,能够总结和归纳实验室制气体的思路。4.通过小组合作,能说出新制氯水的成分及其性质。第15讲富集在海水中的元素---卤素(第一课时)高三化学一轮复习【环节一】预习检测判断下列说法是否正确,并说明理由。(1)过量的铁粉在少量氯气中点燃,充分反应后产物为FeCl2()(2)标况下,22.4LCl2与水充分反应转移电子数为NA()(3)SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果增强()(4)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气()(5)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性()(6)漂白粉的有效成分是CaCl2,漂粉精的有效成分是Ca(ClO)2()(7)漂白粉漂白的原理是Ca(ClO)2+CO2+H2O===CaCO3+2HClO()×××√√√×与变价金属生成高价SO2+Cl2+2H2O===2HCl+H2SO4Cl2+H2OHCl+HClO【环节二】合作学习,突破难点学生活动:请分组讨论以下问题,并将讨论结果以小组的形式展示。1.次氯酸有哪些性质?2.请根据氯气与水的反应,分析新制氯水中含有哪些粒子?3.根据新制氯水的成分,分析新制氯水有何性质?分子:Cl2、H2O和HClO离子:Cl-、H+、ClO-和OH-黄绿色、强氧化性、加成反应沉淀反应酸性弱酸性、强氧化性、不稳定性漂白性(1)弱酸性,比碳酸弱(2)不稳定,容易见光分解(3)强氧化性,能杀死病菌(4)漂白性,永久性漂白光照2HClO=====2HCl+O24.对比归纳:液氯、新制氯水、久置氯水的比较,完成下列表格液氯新制氯水久置氯水分类粒子种类颜色性质纯净物混合物混合物Cl2H+、Cl-、ClO-、OH-、Cl2、H2O、HClOH+、Cl-、OH-、H2O黄绿色浅黄绿色无色氧化性酸性、氧化性、漂白性酸性72KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2OKClO3+6HCl(浓)=KCl+3Cl2↑+3H2O实验室制法:二氧化锰与浓盐酸混合加热MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O思考:如无MnO2时可用什么代替?高锰酸钾、氯酸钾(一)知识铺垫,夯实基础【环节四】合作学习,解决重点浓请从下列仪器中选择并组装一套实验室制备干燥、纯净的氯气的装置。(二)综合应用:1234567abcdefgh按气流方向连接各装置的接口,顺序为?实验室制备氯气的装置图1.如果要验证氯气的性质,应在上图的哪个位置添加?该装置还能制取哪些气体?2.总结气体的收集方法。3.还有哪些气体需要进行尾气吸收?4.气体制备装置一般包含几个部分?各部分的选择依据是什么?(三)归纳总结:请分组讨论下列问题净化装置和尾气吸收之间。HCl、HBr等排气法(向上、向下)和排液法SO2、NOX、CO等1.(装置的连接)下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是A.a—b—c—d—e—f—g—hB.a—e—d—c—b—h—i—gC.a—d—e—c—b—h—i—gD.a—c—b—d—e—h—i—f√【环节四】课堂检测,学以致用2.根据下列装置图回答问题(1)A、B通入Cl2后,观察到的现象是______________________________,根据现象可得出的结论是______________。干燥的有色(或A中)布条不褪色,湿润的有色(或B中)布条褪色Cl2无漂白性,Cl2与水反应生成的HClO有漂白性(2)F装置的作用是________________________。(3)实验开始后,观察装置C中的现象是__________________________。(4)装置E中发生反应的离子方程式是_________________________。(5)通入Cl2时装置D中发生反应的离子方程式是__________________________。吸收氯气,防止污染环境溶液先变为红色,然后褪色2Fe2++Cl2===2Fe3++2Cl-H2O+SO32-+Cl2===2H++SO42-+2Cl-【环节五】学习能力目标细目及达成检测学习能力目标细目目标达成度自检优中差1.说出氯气的物理性质;列举氯气在生活生产中的应用。2.说出氯气与Fe、H2、SO2、H2O、碱、甲烷乙烯的反应方程式。3.说出实验室制氯气的方程式、实验室制气体的思路及各部分装置的作用。4.说出新制氯水的成分及其性质。