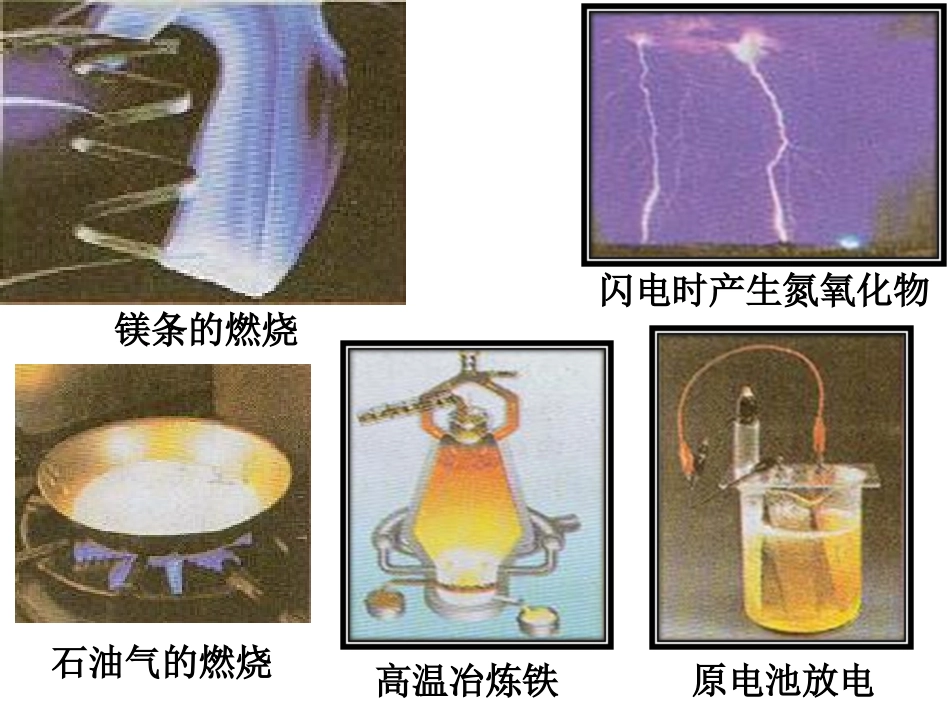
1化学反应中的热量化学反应中的热量第二单元第二单元(1)化学反应的基本特征是,该过程包含着和。(2)浓H2SO4溶于水能量,NH4NO3固体溶于水能量(填“释放”或“吸收”)。(3)日常生活中的两种主要能源:、。反应物中化学键的断裂生成物中化学键的形成有新物质生成释放吸收煤石油镁条的燃烧闪电时产生氮氧化物石油气的燃烧高温冶炼铁原电池放电41.放热反应和吸热反应放热反应:有热量放出的反应叫做放热反应。∑E(反应物)>∑E(生成物)吸热反应:吸收热量的反应叫做吸热反应。∑E(反应物)<∑E(生成物)放热反应吸热反应能量变化反应物的总能量大于生成物的总能量反应物的总能量小于生成物的总能量键能变化生成物的总键能大于反应物的总键能生成物的总键能小于反应物的总键能图示放热反应吸热反应实例①金属和水或酸的反应;②金属氧化物和水或酸的反应;③可燃物的燃烧反应及缓慢氧化;④酸和碱的中和反应;⑤铝热反应;⑥大部分化合反应①大部分分解反应;②以碳、CO、H2为还原剂的氧化还原反应;③Ba(OH)2·8H2O和NH4Cl反应一、化学反应中的热量变化1.放热反应和吸热反应2.化学键与能量变化(1)化学键与能量①破坏化学键,需要能量;②形成化学键,则会能量。吸收释放①吸热反应:断开化学键吸收的能量形成化学键放出的能量放热反应:断开化学键吸收的能量形成化学键放出的能量大于小于②实例:H—HCl—ClH—Cl键能/kJ·mol-1436.4242.7431.8(2)化学键与化学反应能量变化二、热化学方程式1.概念表示化学反应中的化学方程式。2.书写(1)写出正确的。(2)标明物质的状态,用分别代表气态、液态和固态。(3)用标明反应放出或吸收的热量数值,负值表示反应,正值表示反应。放出或吸收的热量放热ΔH化学方程式g、l、s吸热1.热化学方程式的意义和读法(1)意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。(2)读法:如H2(g)+12O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,读为:1mol气态H2与12mol气态O2反应生成1mol水蒸气,放出241.8kJ的热量。2.书写热化学方程式应注意的问题(1)ΔH的意义:ΔH只能写在标有反应物和生成物状态的化学方程式的右边,并用空格隔开。若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”。ΔH的单位一般为kJ·mol-1。(2)反应的条件:书写热化学方程式时应注明ΔH的测定条件,一般情况下ΔH是在25℃、1.01×105Pa下测定的,可不注明温度和压强。(3)化学计量数:注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,因此化学计量数可以是整数,也可以是分数。(4)物质的聚集状态:反应物和生成物的聚集状态不同,反应热ΔH不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”表示。热化学方程式中不用“↑”和“↓”。(5)化学方程式中化学计量数与ΔH的关系:由于ΔH与反应完成的物质的物质的量有关,所以热化学方程式中化学式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反。如H2(g)+12O2(g)===H2O(l)ΔH=-285.8kJ·mol-1,则:H2O(l)===H2(g)+12O2(g)ΔH=+285.8kJ·mol-1,2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1。[例2]已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()A.2H2+O2===2H2OΔH=-484kJ·mol-1B.2H2(g)+O2(g)===2H2O(l)ΔH=-484kJ·mol-1C.2H2(g)+O2(g)===2H2O(g)ΔH=-484kJ·mol-1D.2H2(g)+O2(g)===2H2O(g)ΔH=484kJ·mol-1[解析]书写热化学方程式应注意以下几点:一是物质的化学计量数与ΔH的大小相对应;二是物质的聚集状态与ΔH的大小相对应;三是ΔH的“+”“-”要与吸热反应和放热反应相对应。A选项中未标明状态,B选项方程式中H2O的存在状态与题意不符。D选项ΔH的“+”“-”未标出。[答案]C书写热化学方程式时的常见错误(1)忘记或标错物质的状态。(2)关于ΔH:①漏标“+”或“-”,认为“+”可不标...