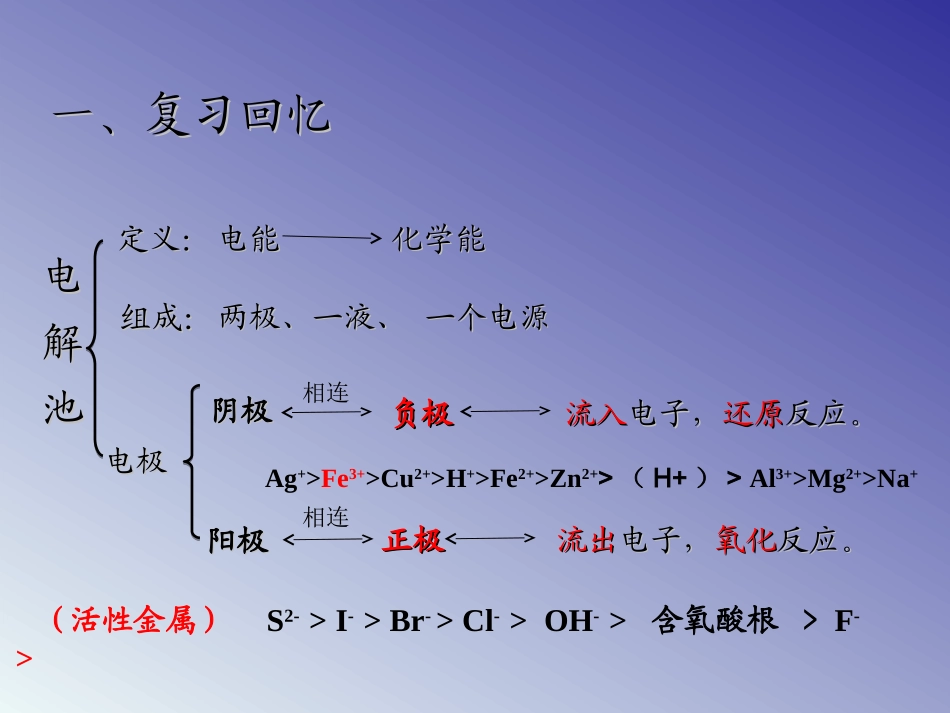
第三节电解池——电解原理及应用陇西二中王平2017.12.09定义:定义:电能化学能电能化学能组成:组成:两极、两极、一液、一液、一个电源一个电源电极电极阳极阳极正极正极流出流出电子,电子,氧化氧化反应。反应。阴极阴极负极负极流入流入电子,电子,还原还原反应。反应。电解池电解池一、一、复习回忆复习回忆相连相连S2->I->Br->Cl->OH->含氧酸根>F-Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+(活性金属)>11、电极产物的判断(惰性电极)、电极产物的判断(惰性电极)NaClNa+Cl-H+OH-阴极产物及电极方程式阳极产物及电极方程式2Cl--2e-=Cl2↑2H++2e-=H2↑Na+OH-2NaCl+2H2O2NaOH+Cl2↑+H2↑电解练习:用惰性电极电解下列物质的溶液练习:用惰性电极电解下列物质的溶液Na2SO4Na+SO42-H+OH-阴极产物及电极方程式阳极产物及电极方程式4OH--4e-=O2↑+2H2O4H++4e-=2H2↑H+OH-2H2OO2↑+2H2↑电解饱和NaCl溶液石墨石墨阳极:阴极:总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑电解2Cl--2e-=Cl2↑2H++2e-=H2↑22、、电解原理的应用电解原理的应用————氯碱工业用惰性电极电解NaCl溶液(1)Cl2接触NaOH溶液会反应,反应方程式:.Cl2+2NaOH=NaCl+NaClO+H2O(2)生成物H2和Cl2混合有什么危险?混合遇火或强光能反应(3)如何不让生成物H2和Cl2混合使用离子交换膜将池分开饱和NaCl溶液石墨石墨交流电解饱和食盐水制烧碱、氯气和氢气交流总结+-精制饱和食盐水水(含少量NaOH)Cl2H2NaOH溶液淡盐水Na+阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑总反应:2NaCl+2H2O====2NaOH+H2↑+Cl2↑(1)生产设备名称:阳离子交换膜电解槽阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室(2)离子交换膜的作用:a、防止Cl2和H2混合而引起爆炸b、避免Cl2与NaOH反应生成NaClO影响NaOH的产量。交流总结1.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液的主要成分判断正确的是()A.a为正极,b为负极;NaClO和NaClB.a为负极,b为正极;NaClO和NaClC.a为阳极,b为阴极;HClO和NaClD.a为阴极,b为阳极;HClO和NaClB三、练习巩固三、练习巩固2.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:(1)写出电解饱和食盐水的离子方程式。(2)离子交换膜的作用为:、。(3)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出(选填“a”、“b”、“c”或“d”)。Cl2+2OH-=Cl-+ClO-+H2Odaa、防止Cl2和H2混合而引起爆炸b、避免Cl2与NaOH反应生成NaClO影响NaOH的产量电极性质电镀电解精炼电解应用氯碱工业概念电冶金电解池应用原理概念放电顺序课后作业预习