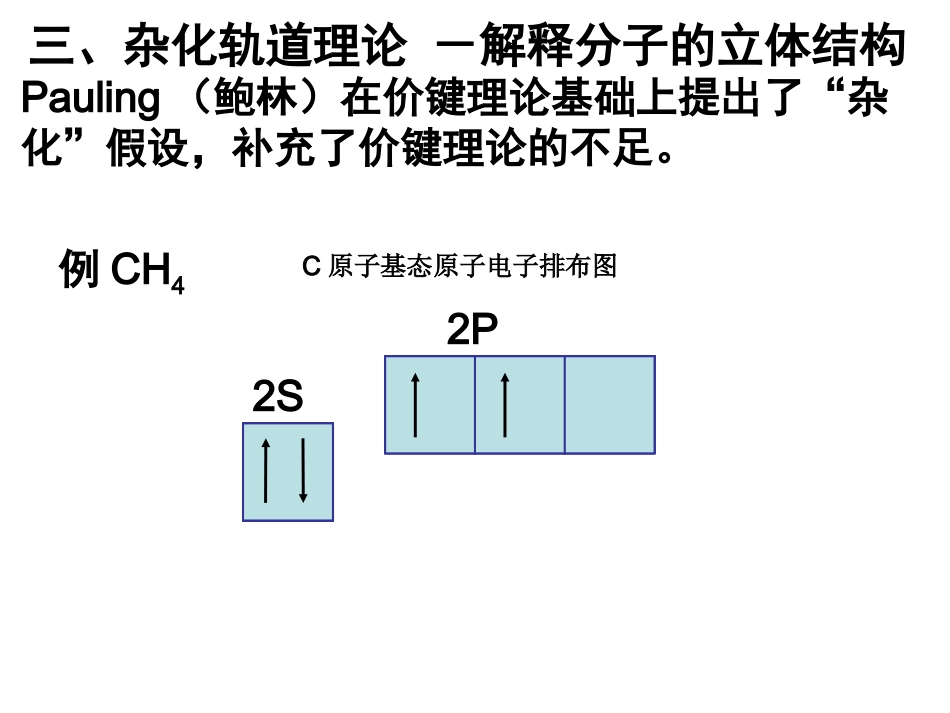
第二节分子的立体构型C的价电子中只有两个未成对电子,为什么CH4分子中C形成四个共价键?3个相互垂直的2p和一个球形的2s与氢原子4个1s原子轨道重叠不可能得到正四面体构型的甲烷疑问?疑问?2P三、杂化轨道理论-解释分子的立体结构Pauling(鲍林)在价键理论基础上提出了“杂化”假设,补充了价键理论的不足。C原子基态原子电子排布图例CH42S2P三、杂化轨道理论-解释分子的立体结构(一)杂化理论要点:1.在形成分子时,每一原子中能量相近能量相近的“轨道”会发生重组,形成新的原子轨道,这个过程称“杂化”,新的原子轨道称“杂化轨道”。2.杂化前后原子“轨道”总数不变,但能量趋于平均化,“杂化轨道”对称性更高,利于成键。3.原子可用“杂化轨道”与其它原子的轨道重叠形成共价键。Pauling(鲍林)在价键理论基础上提出了“杂化”假设,补充了价键理论的不足。(二)杂化类型(二)杂化类型1、sp3杂化:例CH4sp3杂化轨道的形成过程xyzxyzzxyzxyz109°28′基态原子激发态原子1个S轨道和3个P轨道4个相同的SP3杂化轨道混杂实例分析2:试分析BeCl2分子的形成和空间构型。2个含有单电子的2s轨道和2px轨道进行sp杂化,组成夹角为1800的2个能量相同的sp杂化轨道,所以BeCl2分子的空间构型为直线型。sp杂化轨道的形成过程xyzxyzzxyzxyz180°实例分析2:试说明BF3分子的空间构型。1个2s轨道和2个2p轨道进行sp2杂化,形成夹角均为1200的3个完全等同的SP2杂化轨道。所以BF3分子的空间构型为平面正三角型。sp2杂化轨道的形成过程xyzxyzzxyzxyz120°杂化类型spsp2sp3参与杂化的原子轨道1个s+1个p1个s+2个p1个s+3个p杂化轨道数2个sp杂化轨道3个sp2杂化轨道4个sp3杂化轨道杂化轨道间夹角18001200109028’空间构型直线正三角形正四面体实例BeCl2,C2H2BF3,C2H4CH4,CCl4三种杂化轨道的比较(三)杂化轨道的应用范围:杂化轨道只用于形成σ键或者用来容纳未参加成键的孤电子对。杂化轨道个数=价层电子对数(未参与杂化的p轨道可形成键)杂化类型的判断方法:先确定分子或离子的中心原子价层电子对数,再由杂化轨道数判断杂化轨道类型。互斥模型(VSEPR)与杂化轨道类型价层电子对数杂化类型VSEPR模型2sp杂化直线形3sp2杂化平面三角形4sp3杂化四面体形了解5sp3d(或dsp3)杂化三角双锥形6sp3d2(或d2sp3)杂化正八面体利用中心原子杂化轨道类型可判断分子的立体构型一般方法:1、看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,用去了2个P轨道,形成的是SP杂化;如果有1个双键则其中有1个π键,形成的是SP2杂化;如果全部是单键,则形成的是SP3杂化。2、没有填充电子的空轨道一般不参与杂化,1对孤电子对占据1个杂化轨道。•例题一:下列分子中的中心原子杂化轨道的类型相同的是()•A.CO2与SO2B.CH4与NH3•C.BeCl2与BF3D.C2H2与C2H4B例题二:对SO2与CO2说法正确的是()A.都是直线形结构B.中心原子都采取sp杂化轨道C.S原子和C原子上都没有孤对电子D.SO2为V形结构,CO2为直线形结构D课堂练习•1.下列物质中,分子的立体结构与水分子相似的是()•A.CO2B.H2SC.PCl3D.SiCl4•2.下列分子的立体结构,其中属于直线型分子的是()•A.H2OB.CO2C.C2H2D.P4BBC无色实验实验2-12-1固体颜色固体颜色溶液颜色溶液颜色天蓝色天蓝色天蓝色无色无色CuSOCuSO44CuClCuCl22..2H2H22OOCuBrCuBr22NaClNaClKK22SOSO44KBrKBr白色白色绿色绿色深褐色深褐色白色白色白色白色白色白色思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?结论:上述实验中呈天蓝色的物质叫做四水合铜离子,可表示为[Cu(H2O)4]2+。在四水合铜离子中,铜离子与水分子之间的化学键是由水分子中的O原子提供孤对电子对给予铜离子(铜离子提供空轨道),铜离子接受水分子的孤对电子形成的,这类“电子对给予—接受键”被称为配位键。CuOH2H2OH2OH2O2+1、配位键:共用电子对由一个原子单方面提供给另一个原子共用所形成的共价键叫配位键。是一种特殊的共价键。2、配位化合物:中心离子(或原子)与配位体(某些分子或离子)以配位键的形式结合而成的化合...