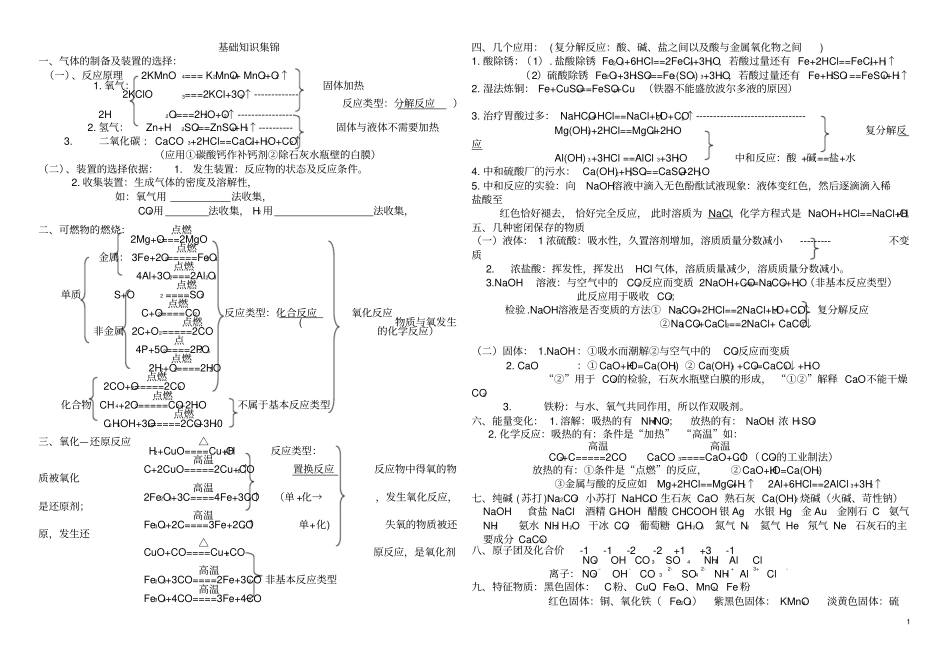
1基础知识集锦一、气体的制备及装置的选择:(一)、反应原理2KMnO4===K2MnO4+MnO2+O2↑1.氧气:固体加热2KClO3===2KCl+3O2↑-------------反应类型:分解反应)2H2O2===2H2O+O2↑-----------------2.氢气:Zn+H2SO4==ZnSO4+H2↑----------固体与液体不需要加热3.二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑(应用①碳酸钙作补钙剂②除石灰水瓶壁的白膜)(二)、装置的选择依据:1.发生装置:反应物的状态及反应条件。2.收集装置:生成气体的密度及溶解性,如:氧气用法收集,CO2用法收集,H2用法收集,二、可燃物的燃烧:点燃2Mg+O2===2MgO点燃金属:3Fe+2O2=====Fe3O4点燃4Al+3O2===2Al2O3点燃单质S+O2====SO2点燃C+O2====CO2反应类型:化合反应氧化反应点燃(物质与氧发生非金属2C+O2=====2CO的化学反应)点4P+5O2====2P2O5点燃2H2+O2====2H2O点燃2CO+O2=====2CO2点燃化合物CH4+2O2=====CO2+2H2O不属于基本反应类型点燃C2H5OH+3O2=====2CO2+3H20三、氧化—还原反应△H2+CuO====Cu+H2O反应类型:高温C+2CuO=====2Cu+CO2↑置换反应反应物中得氧的物质被氧化高温2Fe2O3+3C====4Fe+3CO2↑(单+化→,发生氧化反应,是还原剂;高温Fe3O4+2C====3Fe+2CO2↑单+化)失氧的物质被还原,发生还△CuO+CO====Cu+CO2原反应,是氧化剂高温Fe2O3+3CO====2Fe+3CO2非基本反应类型高温Fe3O4+4CO====3Fe+4CO2四、几个应用:(复分解反应:酸、碱、盐之间以及酸与金属氧化物之间)1.酸除锈:(1).盐酸除锈Fe2O3+6HCl==2FeCl3+3H2O,若酸过量还有Fe+2HCl==FeCl2+H2↑(2)硫酸除锈Fe2O3+3H2SO4==Fe2(SO4)3+3H2O,若酸过量还有Fe+H2SO4==FeSO4+H2↑2.湿法炼铜:Fe+CuSO4==FeSO4+Cu(铁器不能盛放波尔多液的原因)3.治疗胃酸过多:NaHCO3+HCl==NaCl+H2O+CO2↑--------------------------------Mg(OH)2+2HCl==MgCl2+2H2O复分解反应Al(OH)3+3HCl==AlCl3+3H2O中和反应:酸+碱==盐+水4.中和硫酸厂的污水:Ca(OH)2+H2SO4==CaSO4+2H2O5.中和反应的实验:向NaOH溶液中滴入无色酚酞试液现象:液体变红色,然后逐滴滴入稀盐酸至红色恰好褪去,恰好完全反应,此时溶质为NaCl,化学方程式是NaOH+HCl==NaCl+H2O。五、几种密闭保存的物质(一)液体:1浓硫酸:吸水性,久置溶剂增加,溶质质量分数减小---------不变质2.浓盐酸:挥发性,挥发出HCl气体,溶质质量减少,溶质质量分数减小。3.NaOH溶液:与空气中的CO2反应而变质2NaOH+CO2==Na2CO3+H2O(非基本反应类型)此反应用于吸收CO2;检验.NaOH溶液是否变质的方法①Na2CO3+2HCl==2NaCl+H2O+CO2↑复分解反应②Na2CO3+CaCl2==2NaCl+CaCO3↓(二)固体:1.NaOH:①吸水而潮解②与空气中的CO2反应而变质2.CaO:①CaO+H2O=Ca(OH)2②Ca(OH)2+CO2=CaCO3↓+H2O“②”用于CO2的检验,石灰水瓶壁白膜的形成,“①②”解释CaO不能干燥CO23.铁粉:与水、氧气共同作用,所以作双吸剂。六、能量变化:1.溶解:吸热的有NH4NO3;放热的有:NaOH、浓H2SO42.化学反应:吸热的有:条件是“加热”“高温”如:高温高温CO2+C=====2COCaCO3====CaO+CO2↑(CO2的工业制法)放热的有:①条件是“点燃”的反应,②CaO+H2O=Ca(OH)2③金属与酸的反应如Mg+2HCl==MgCl2+H2↑2Al+6HCl==2AlCl3+3H2↑七、纯碱(苏打)Na2CO3小苏打NaHCO3生石灰CaO熟石灰Ca(OH)2烧碱(火碱、苛性钠)NaOH食盐NaCl酒精C2H5OH醋酸CH3COOH银Ag水银Hg金Au金刚石C氨气NH3氨水NH3H2O干冰CO2葡萄糖C6H12O6氮气N2氦气He氖气Ne石灰石的主要成分CaCO3八、原子团及化合价-1-1-2-2+1+3-1NO3OHCO3SO4NH4AlCl离子:NO3–OH-CO32-SO42-NH4+Al3+Cl-九、特征物质:黑色固体:C粉、CuO、Fe3O4、MnO2、Fe粉红色固体:铜、氧化铁(Fe2O3)紫黑色固体:KMnO4淡黄色固体:硫2溶液:棕黄色(黄色)溶液FeCl3、Fe2(SO4)3溶液;浅绿色溶液:FeCl2、FeSO4溶液蓝色溶液:CuSO4溶液;其他溶液大多为无色。沉淀:蓝色沉淀:Cu(OH)2红褐色沉淀:Fe(OH)3不溶于稀硝酸的白色沉淀有AgClBaSO4其他沉淀一般均为白色且溶于酸,如:CaCO3BaCO3Mg(OH)2Al(OH)3十、元素之最:1.地壳中最多的元素:氧,最多的金属元素:铝;其顺序为:养闺女(氧、硅、铝);2.人体中最...