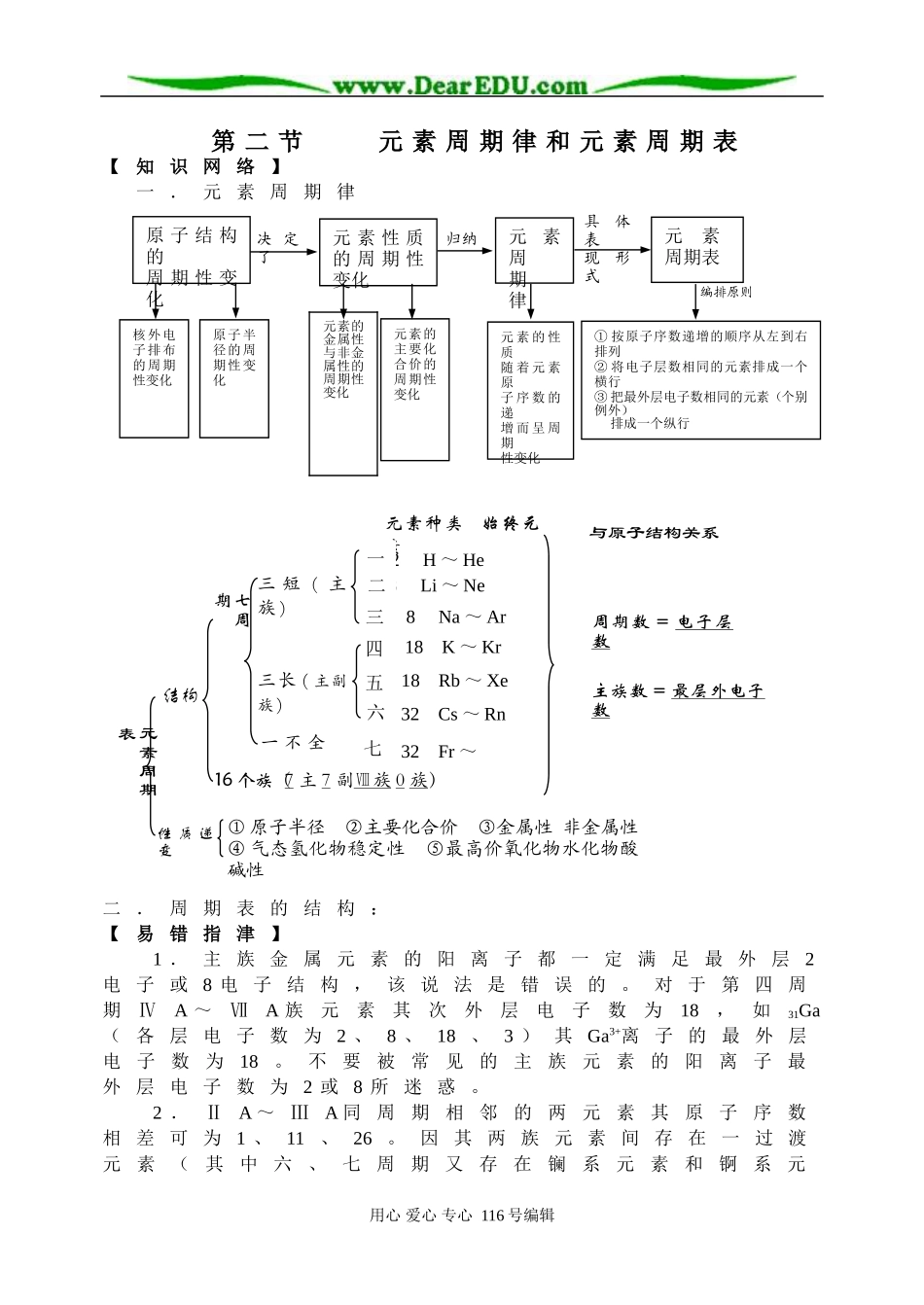
第二节元素周期律和元素周期表【知识网络】一.元素周期律二.周期表的结构:【易错指津】1.主族金属元素的阳离子都一定满足最外层2电子或8电子结构,该说法是错误的。对于第四周期ⅣA~ⅦA族元素其次外层电子数为18,如31Ga(各层电子数为2、8、18、3)其Ga3+离子的最外层电子数为18。不要被常见的主族元素的阳离子最外层电子数为2或8所迷惑。2.ⅡA~ⅢA同周期相邻的两元素其原子序数相差可为1、11、26。因其两族元素间存在一过渡元素(其中六、七周期又存在镧系元素和锕系元用心爱心专心116号编辑元素的金属性与非金属性的周期性变化编排原则决定了归纳原子结构的周期性变化元素性质的周期性变化具体表现形式元素周期律元素周期表核外电子排布的周期性变化原子半径的周期性变化元素的主要化合价的周期性变化元素的性质随着元素原子序数的递增而呈周期性变化①按原子序数递增的顺序从左到右排列②将电子层数相同的元素排成一个横行③把最外层电子数相同的元素(个别例外)排成一个纵行8Li~Ne2H~He与原子结构关系元素种类始终元素周期数=电子层数主族数=最层外电子数三短(主族)一二三五六七七周期16个族(7主7副Ⅷ族0族)①原子半径②主要化合价③金属性非金属性④气态氢化物稳定性⑤最高价氧化物水化物酸碱性性质递变元素周期表结构四8Na~Ar18K~Kr18Rb~Xe32Cs~Rn32Fr~三长(主副族)一不全素)。3.应用元素周期律和元素在周期表的位置推导未知元素的性质时,防止机械类比,如Be、Al性质相似,但氧化铍的化学式为BeO而不是Be2O3。4.应用周期表导出元素再求化学式时,对C元素应考虑C元素形成的有机物,以防漏选。5.试题常用筛选法、具体法、定位法判断法、逻辑推理法等解题。【典型例题评析】例1X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是(1996年全国高考题)A.X的原子序数比Y的小B.X原子的最外层电子数比Y的大C.X的原子半径比Y的大D.X元素的最高正价比Y的小思路分析:本题主要考查元素周期律和元素周期表知识的应用和逻辑推理能力。A:X元素失去电子后与Y元素得到电子后的电子数相等,说明X元素的原子序数大于Y元素的原子序数,A错;B:X元素应为金属元素,最外层电子数小于或等于4,Y元素为非金属元素,最外层电子数大于或等于4,B错;C:X原子比Y原子多一电子层,且X为金属元素,Y为非金属元素,所以半径大;D:X元素有阳离子,为金属元素,Y元素为阴离子,为非金属元素,非金属元素的最高正价高于金属元素的最高正价。一题多解:根据“X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构”,已知阴离子与该原子具有相同电子层数,阳离子比该原子少一个电子层,氩原子是第三周期的惰性元素,它们在元素周期表中的位置是:3YAr4X从上述划草图可知,X、Y在相邻周期,Y在X元素的上一周期,是非金属,X的原子序数比Y大,A错。X是金属元素,原子的最外层电子数X比Y少,B错。X原子半径比Y大,因为X元素比Y多一个电子层,X是金属元素,相同周期中是原子半径较大者。在相同周期里元素的原子半径从左到右逐渐减小,Y元素是同周期中原子半径较小者,因此,X的原用心爱心专心116号编辑子半径一定大于Y,C对。X原子在第四周期,可能是钾、钙等,阳离子的电子层结构和惰性元素氩相同,X的最高正价可能是+1、+2等,Y元素可能是第三周期的磷、硫、氯等,它们的阴离子与氩原子具有相同的电子层结构,其最高正价分别为+5、+6、+7,所以X元素的最高正价比Y元素小,D对。答案:C、D方法要领:依据离子结构特点推断元素在周期表中位置是解本题的关键。把X、Y元素在元素周期表中定位后,它们的原子结构、电子层数、最外层电子数、最高正价以及原子半径递变规律都能顺利推断了。要注意将原子半径大小的比较与阴、阳离子半径大小的比较严格区别开来。其规律是-----电子层结构相同的单离子:①所在周期:阴离子n周期,阳离子在n+1周期②原子序数:阳离子>阴离子③微粒半径:阴离子>阳离子④元素最高正价:阴离子的元素>阳离子的元素用一句话概括:“阴前阳下,径小序大”,即与稀有气体元素同周期的阴离子,和该稀有气体元素下周期的阳离子,及这种稀有...