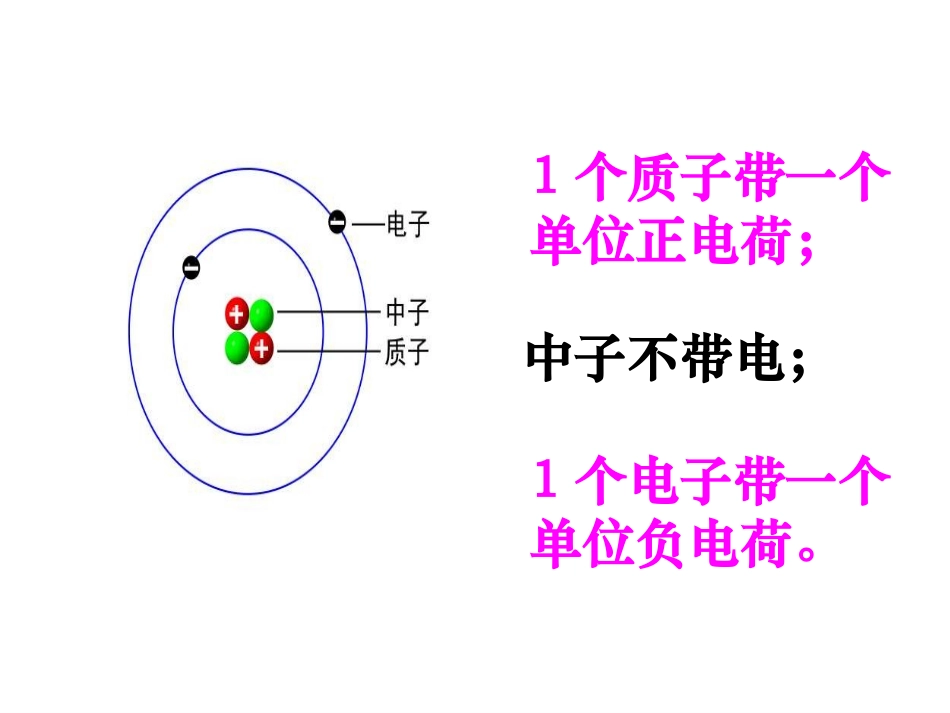
第三节:原子的构成(第2课时)原子结构动画模拟复习:1个质子带一个单位正电荷;1个电子带一个单位负电荷。中子不带电;原子原子核原子核核外电子核外电子质子质子中子中子(每个质子带1个单位正电荷)(不带电)(每个电子带1个单位负电荷)核电荷数=质子数=核外电子数原子种类原子核核外电子数质子数中子数氢101碳666氧888钠111211磷151615硫161616氯171817观察下表,你能从中获得哪些信息?1、质子数=核外电子数2、不是所有的原子都含有中子3、核内质子数不同,则原子种类不同4、质子数不一定等于中子数从表中可以得出:核外电子分层排布•电子按能量高低在核外分层排布1234567KLMNOPQ由内到外,能量逐渐升高电子层符号:KLMNOPQ电子层序数(n):1234567电子离核的距离:近远电子具有的能量:低高核外电子的分层排布(又叫分层运动)原子结构示意图如:钠原子的结构示意图电子层每个电子层上的电子数核内质子数原子核核外电子的排布规律3、电子总是最先排布在能量低的电子层,然后才是能量高的电子层。1、每一电子层上最多排2n2个电子(n为电子层数)。2、最外层上的电子数不能超过8个(只有一个电子层时不能超过2个)。Cl:17Mg:12O:8H:1画出下列原子的结构示意图部分金属元素的原子结构示意图钠:镁:铝:锂:部分非金属元素的原子结构示意图碳:磷:硫:氯:部分稀有气体元素的原子结构示意图三类元素原子最外层电子数目的特点原子种类金属原子非金属原子稀有气体原子原子的最外层电子数特征电子得失情况<4个在化学反应中易失去电子≥4个在化学反应中易得到电子不易得失电子8个(He为2个)总结:元素的性质,特别是化学性质,跟它的原子的关系密切。在化学反应中,是不变的,发生改变的只是。最外层电子数原子核核外电子带电的原子或原子团带正电荷的离子叫阳离子带负电荷的离子叫阴离子离子:氯化钠的形成动画氯化钠的形成动画食盐晶体分子、原子、离子的比较原子分子离子共性区别联系都是构成物质的粒子,都很小、不停运动、微粒间有间隔在化学变化中不能再分,且种类不变。在化学变化中可以再分且种类改变。带电的微粒分子是由原子构成,分子又可以再分为原子,原子得失电子后变为离子。电子云:阅读课本1、下列微粒是阳离子的有();是阴离子的有()是原子的有();为稳定结构的有()ABCDABCDBCD练一练2、下列原子的电子层排布相同的是()2.3.63、下列具有相似化学性质的元素组别是:。ABCDCD挑战自我1、将①分子②原子③质子④中子⑤电子⑥离子等粒子用序号分别填入下列适当空格中:(1)构成物质的基本粒子是________________(2)构成原子的基本粒子是________________(3)显示电中性的粒子是________________(4)带正电的粒子是________________(5)参加化学反应一定发生变化的粒子是____________(6)原子中数目一定相等的粒子是_______________①②⑥③④⑤①②④③①③⑤原子种类质子数中子数核外电子数相对原子质量氢1011碳66612氧88816钠11121123磷151615312、观察下表,你能够从中获得哪些信息?1、质子数=核外电子数2、不是所有的原子都含有中子3、核内质子数不同,则原子种类不同4、质子数不一定等于中子数5、相对原子质量≈质子数+中子数家庭作业以假如我是一个原子写一篇小短文(200字左右)