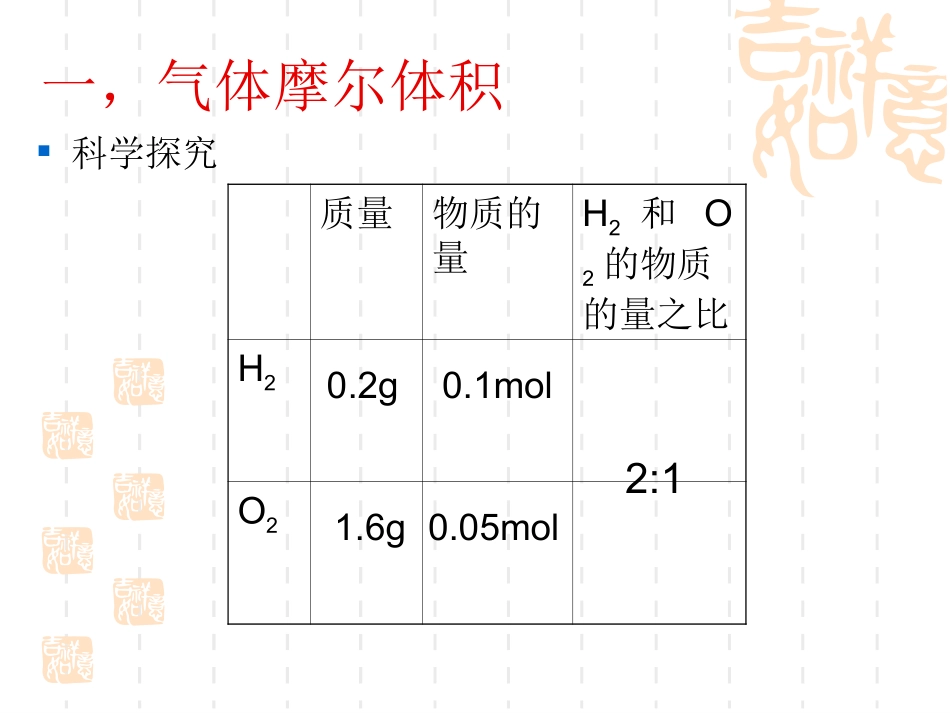
化学计量在实验中的应用(2)——气体摩尔体积学习目标:理解气体摩尔体积的概念,学会有关气体摩尔体积的计算。一,气体摩尔体积科学探究质量物质的量H2和O2的物质的量之比H2O20.2g0.1mol1.6g0.05mol2:12H2O=2H2+O2电解0.1mol0.1mol0.05mol在相同的状态下,氢气与氧气的体积比等于物质的量之比。1.8g0.2g1.6g36432密度∕g/l1mol物质的体积O21.429H20.089922.3922.24密度∕g.cm31mol物质的体积Fe7.86Al2.70H2O0.998H2SO41.837.12cm310cm318.04ml53.55ml物质体积的决定因素:粒子的数目粒子的大小粒子之间的距离1mol气体的体积决定于气体分子间的距离,气体分子间的距离受温度,压强的影响,所以在相同状态下,1mol气体的体积“基本相同”。1mol固体和液体的体积决定于粒子本身的大小,而粒子的大小是不相等的,因此1mol固体和液体的体积不同。气体摩尔体积:单位物质的量的气体所占的体积。符号为Vm,,常用的单位有L/mol和m3/mol.Vm=—PV=nRTVnVm=—Vn=RT—P在0℃和101kPa(标准状况)的条件下,气体摩尔体积约为22.4L/mol.思考:气体摩尔体积约为22.4L/mol,只有在标准状况吗?怎样理解(标准状况)的条件下,1mol气体的体积约为22.4L?前提:标准状况物质的量:1mol对象:任何气体,包括混合气体体积:约为22.4L判断下列说法正误:1.标准状况下,6.02×1023个分子所占的体积约为22.4L.()2.标准状况下,1molH2O的体积约为22.4L()3.标准状况下,28gCO和N2混合气体的体积约为22.4L。()物质的质量m(g)÷M×M物质的量n(mol)×NA÷NA物质的粒子数N÷Vm×Vm气体体积V(L)本节要点归纳:气体摩尔体积的概念及有关气体摩尔体积的计算。特别注意对Vm=22.4mol/L的理解。