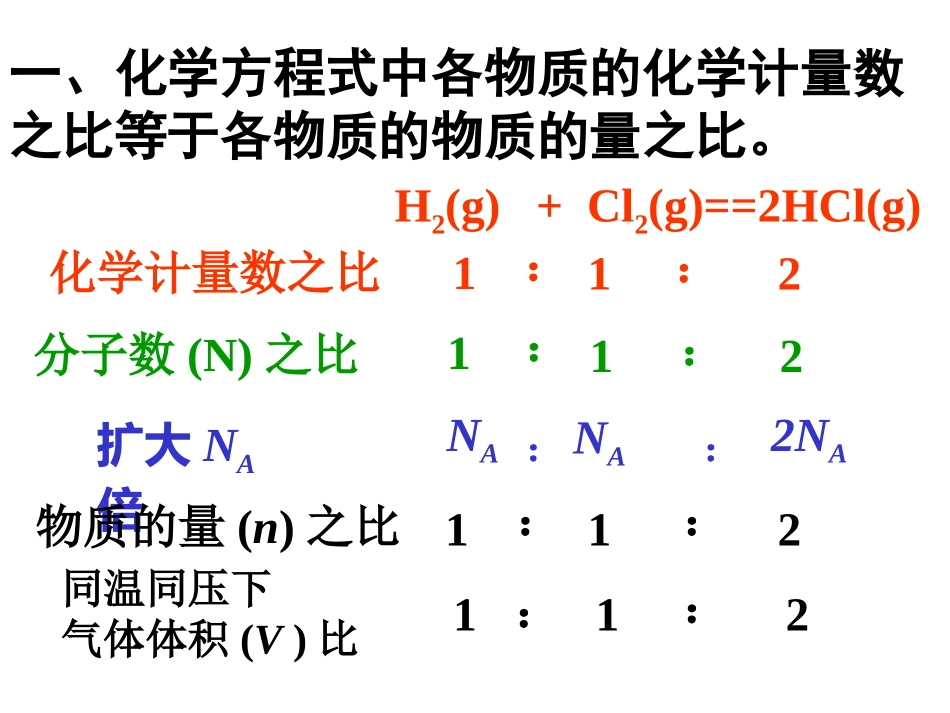
物质的量应用于方程式的计算专题讲解H2(g)+Cl2(g)==2HCl(g)化学计量数之比112::分子数(N)之比扩大NA倍1:1:2NANA2NA::物质的量(n)之比112::同温同压下气体体积(V)比112::一、化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。二、物质的量应用于化学方程式的计算时,题目中常给出以下条件:物质的量(n)体积(V)质量(m)物质的量浓度(CB)隐含条件:气体摩尔体积(Vm)摩尔质量1、已知某物质的量的计算10.5moln(HNO3)=0.5molNaOH+HNO3==NaNO3+H2O【例1】完全中和0.5molNaOH需多少摩的HNO3?其质量是多少克?解:答:完全中和0.5molNaOH需0.5molHNO3其质量为31.5g1n(HNO3)=11n(HNO3)0.5molm(HNO3)=0.5mol×63g/mol=31.5g这是最基础的题目,直接将物质的量应用到化学方程式中。2.已知某物质的质量,进行计算。此类计算常需要利用物质的摩尔质量,先把质量换算成物质的量,然后再进行计算[强调]在这里,很多同学会按自己熟悉的方式用质量计算,再换算成物质的量。这样就违背了我们这堂课的目的。所以,一定要用物质的量代入方程式计算。n(CaCO3)=m(CaCO3)M(CaCO3)=分析:求出参加反应CaCO3物质的量,再根据化学方程式中的化学计量数进行计算。【例2】用60g含CaCO380%的大理石与足量12mol/L浓盐酸完全反应(杂质不参加反应)求:①参加反应浓盐酸的体积。②生成CO2的体积(标况下)。解:(CaCO3)60g×80%100g/mol=0.48mol1molV液=2×0.48mol2mol0.48mol答:参加反应浓盐酸体积为0.08L,生成CO2的体积在标况下10.75L。CaCO3+2HCl==CaCl2+CO2+H2O12mol/L×V1×12mol/L=0.08L22.4LV(CO2)V(CO2)=0.48mol×22.4L1mol=10.752L【练习1】实验室里用MnO2和浓盐酸制取Cl2。若有8.7gMnO2完全反应,则被MnO2氧化的Cl-物质的量为多少摩?生成Cl2在标准状况下体积为多少升?解:1moln(HCl)2mol8.7g87g/molxMnO2+4HCl==MnCl2+Cl2+2H2O设被氧化Cl-物质的量为n,生成Cl2的体积在标况下为x22.4L/mol被氧化的是2HCl答:被氧化的Cl-为0.2mol,生成2.24L氯气。n(HCl)=0.2molx=2.24Ln(HCl)=2mol×0.1mol1molx=0.1mol×22.4L/mol3.己知标准状况下,进行某气体的有关计算此类解题途径是根据n=V/Vm把体和换算成物质的量,然后再进行计算。2mol5.8L22.4L1molC(NaOH)×0.4Ln(NaClO)答:生成NaClO0.26mol,NaOH物质的量浓度为1.3mol/L2NaOH+Cl2=NaCl+NaClO+H2O【例3】400ml某浓度的NaOH溶液恰好5.8LCl2(标准状况)完全反应,求:⑴生成的NaClO的物质的量。⑵该溶液中NaOH的物质的量浓度。n(NaClO)=5.8L×1mol22.4L=0.26mol⑴解:⑵C(NaOH)=5.8L×2mol0.40L×22.4L=1.3mol/L【练习2】5molH2SO4和和Zn完全反应,能生成多少gH2?这些H2标准状况下体积为多少升?解:1mol1mol:5mol=1mol:x设能生成的氢气的物质的量为xZn+H2SO4=ZnSO4+H21mol5molxx=5molm(H2)=5mol×2g/mol=10g答:能生成10gH2,标况下体积为112LV(H2)=5mol×22.4L/mol=112L1mol:5mol=22.4L:y解法2:1mol1mol:5mol=2g:x设能生成的氢气的质量为x标况下体积为yZn+H2SO4=ZnSO4+H22g5molxx=10g答:能生成10gH2,标况下为112L。22.4Lyy=112L4.己知物质的量浓度的计算根据CB=nB/V求出某些物质的量后再进行计算。【例4】在200mL0.5mol/LNaCl溶液中滴入足量AgNO3溶液,生成多少克沉淀?n(NaCl)=0.5mol/L×0.2L=0.1moln(AgCl)110.1moln(AgCl)=0.1mol答:能生成14.35gAgCl沉淀。NaCl+AgNO3=AgCl+NaNO3解:m(AgCl)=0.1mol×143.5g/mol=14.35g5.综合计算。灵活运用:n=m/M,n=N/NA,n=V/Vm,CB=nB/V液,=m/V,%=m质/m液×100%解:①可利用HCl的质量分数和盐酸密度换算出盐酸物质的量浓度。=1000mL×g/cm3×%【例5】某盐酸=1.05g/cm3,HCl质量分数10%。计算:①该盐酸物质的量浓度为多少?②将Zn粉0.65g投入50ml盐酸中充分反应,生成的H2的体积(标准状况)是多少?若反应完成后溶液体积保持不变则生成ZnCl2物质的量浓度是多少?Mg/mol×1L1000mL×1.05g/cm3×10%C(HCl)=36.5g/mol×1L=2.88mol/L②Zn+2HCl==ZnCl2+H2n(ZnCl2)110.65g165g/moln(H2)n(ZnCl2)=0.01moln(H2)=0.01molC(ZnCl2)=0.01mol0.05L=0.2mol/LV(H2)=0.01mol...