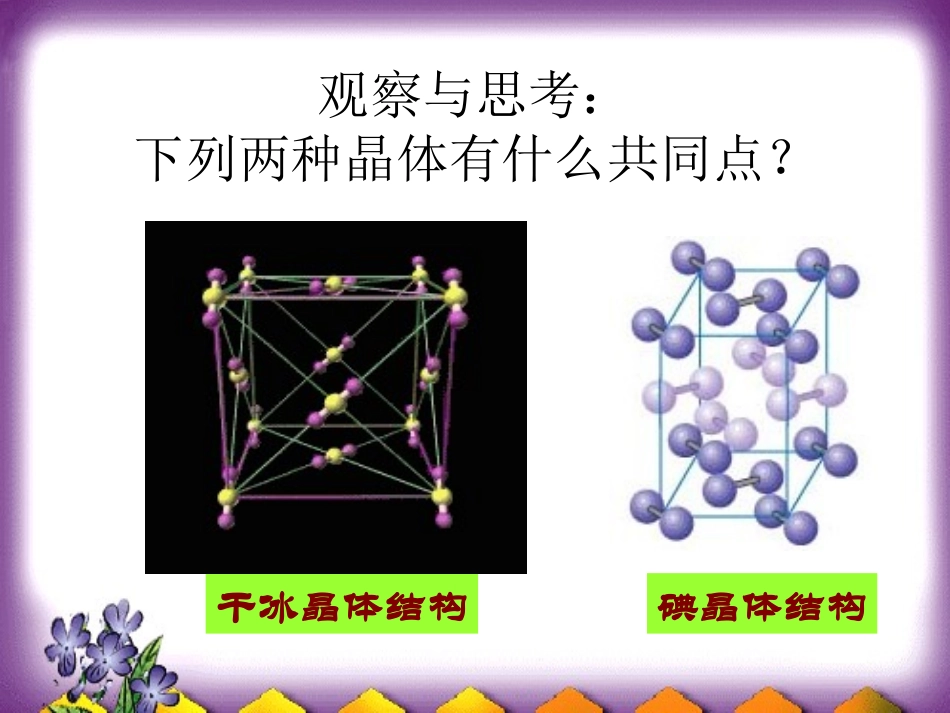
第第第第第第第第第第第第第第第第第第第第第第第第第第第第第第观察与思考:下列两种晶体有什么共同点?碘晶体结构干冰晶体结构分子晶体概念:分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体。构成粒子:分子(构成分子的原子间以共价键结合)构成粒子间的相互作用:分子间作用力。气化或熔化是破坏的作用力:分子间作用力。稀有气体分子为单原子分子,无共价键。组成和结构相似时,相对分子质量越大分子间作用力越大,熔沸点越高。有氢键时,熔沸点升高。分子晶体有哪些物理特性,为什么?分子晶体有哪些物理特性,为什么?分子晶体的物理特性:分子晶体的物理特性:–较低的熔点和沸点较低的熔点和沸点–较小的硬度(多数分子晶体在常温较小的硬度(多数分子晶体在常温时为气态或液态)时为气态或液态)–一般都是绝缘体,固态或熔融状态一般都是绝缘体,固态或熔融状态也不导电。也不导电。–溶解性与溶质、溶剂的分子的极性溶解性与溶质、溶剂的分子的极性相关相关————相似相溶。相似相溶。原因:分子间作用力很弱原因:分子间作用力很弱下列属于分子晶体的性质的是()A、熔点1070℃,易溶于水,水溶液能导电B、能溶于CS2,熔点112.8℃,沸点444.6℃C、熔点1400℃,可做半导体材料,难溶于水D、熔点97.81℃,质软,导电,密度0.97g/cm-3B典型的分子晶体:–所有非金属氢化物:H2O,H2S,NH3,CH4,HX,PH3,SiH4等–所有的酸:H2SO4,HNO3,H3PO4等–部分非金属单质:X2,O2,H2,S8,P4,C60,稀有气体等–部分非金属氧化物:CO2,SO2,NO2,P4O6、P4O10等–大多数有机物:乙醇,冰醋酸,蔗糖等下列属于分子晶体的一组物质是()A、CaO、NO、COB、CCl4、H2O2、HeC、CO2、SO2、NaClD、CH4、O2、Na2OB分子晶体结构特征(1)只有范德华力,无分子间氢键-分子密堆积(每个分子周围有12个紧邻的分子,如:C60、干冰、I2、O2)(2)有分子间氢键-不具有分子密堆积特征(如:HF、冰、NH3)分子的密堆积分子的密堆积(与每个分子距离最近的相同分子共有(与每个分子距离最近的相同分子共有1212个)个)氧(O2)的晶体结构碳60的晶胞分子的密堆积分子的密堆积(与(与COCO22分子距离最近分子距离最近的的COCO22分子共有分子共有1212个个))干冰的晶体结构图冰中1个水分子周围有4个水分子冰中1个水分子周围有4个水分子冰的结构冰的结构氢键具有方向性氢键具有方向性分子的非密堆积分子的非密堆积笼装化合物练习1:下列各组物质各自形成晶体,均属于分子晶体的化合物是()A.NH3、HD、C10H8B.PCl3、CO2、H2SO4C.SO2、SO3、C60D.CCl4、Na2S、H2O2练习2:下列分子晶体,关于溶、沸点高低叙述中,正确的是()A.Cl2>I2B.SiCl4>CCl4C.NH3
CH3(CH2)3CH3BB3.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是()A.干冰B.氯化钠C.氢氧化钠D.碘思考与交流思考与交流•CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。•碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?180º109º28´SiO共价键二氧化硅晶体结构示意图二氧化硅的晶体结构二氧化碳的晶体结构109º28´共价键金刚石的晶体结构示意图原子晶体概念:相邻原子间以共价键相结合而形成空间立体网状结构的晶体。构成粒子:原子构成粒子之间的作用:共价键熔化时需克服的作用:共价键原子晶体中,成键元素原子半径越小,共价键键能越大,熔点越高。练习1、碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是()A、①③②B、②③①C、③①②D、②①③A思考:(1)在金刚石晶体中,C采取什么杂化方式?每个C与多少个C成键?形成怎样的空间结构?每个碳原子周围紧邻的碳原子有多少个?最小碳环由多少个碳原子组成?它们是否在同一平面内?(2)在金刚石晶体中,C原子个数与C—C键数之比为多少?(3)12克金刚石中C—C键数为多少NA?金刚石的结构特征在金刚石...