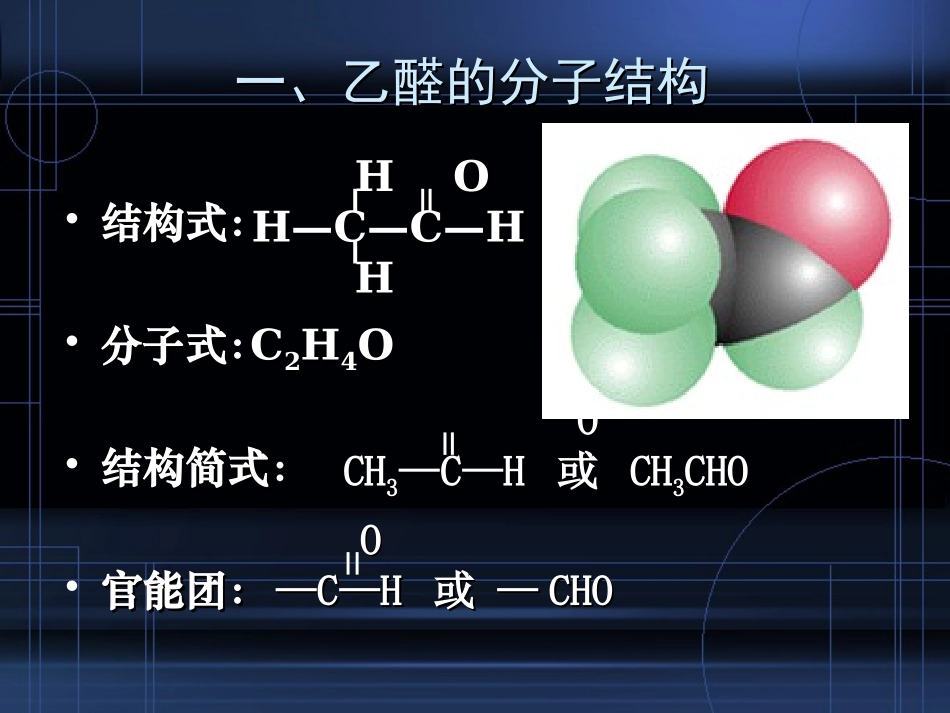
第五节乙醛第五节乙醛一、乙醛的分子结构一、乙醛的分子结构•结构式:结构式:•分子式:分子式:•结构简式:结构简式:•官能团:官能团:CC22HH44OOHOHOH—C—C—HH—C—C—HHHOOCHCH33—C—H—C—H或或CHCH33CHOCHOOO——C—HC—H或—或—CHOCHO二、乙醛的物理性质二、乙醛的物理性质•11、无色、有刺激性气味的液体;、无色、有刺激性气味的液体;•22、密度比水小,沸点是、密度比水小,沸点是20.8℃20.8℃;;•33、易挥发,易燃烧;、易挥发,易燃烧;•44、能跟水、乙醇、氯仿等互溶。、能跟水、乙醇、氯仿等互溶。三、乙醛的化学性质三、乙醛的化学性质11、乙醛的加成反应、乙醛的加成反应++HH22NiNi△△把有机物分子中把有机物分子中加入氢原子加入氢原子或或失失去氧原子去氧原子的反应叫做的反应叫做还原反应还原反应。。把有机物分子中把有机物分子中加入氧原子加入氧原子或或失失去氢原子去氢原子的反应叫做的反应叫做氧化反应氧化反应。。HHHHH—C—C=OH—C—C=OHHHHHHH—C—C—OH—C—C—OHHHHHH思考:在有机物中引入羟基的方法?三、乙醛的化学性质三、乙醛的化学性质22、乙醛的氧化反应、乙醛的氧化反应①①催化氧化催化氧化乙醇乙醇氧化(脱氢)氧化(脱氢)还原(加氢)还原(加氢)氧化(加氧)氧化(加氧)乙醛乙醛乙酸乙酸工业制乙酸工业制乙酸OO2CH2CH33—C—H—C—H+O+O222CH2CH33COOHCOOH催化剂催化剂△△(1)与氧气的反应三、乙醛的化学性质三、乙醛的化学性质22、乙醛的氧化反应、乙醛的氧化反应2CH2CH33CHO+5OCHO+5O224CO4CO22+4H+4H22OO点燃点燃②②燃烧燃烧(2)使酸性高锰酸钾溶液腿色三、乙醛的化学性质三、乙醛的化学性质22、乙醛的氧化反应、乙醛的氧化反应CHCH33CHO+2CHO+2Cu(OH)Cu(OH)22CHCH33COOHCOOH++CuCu22OO+2H+2H22OO△△((33)被弱氧化剂氧)被弱氧化剂氧化化现象:现象:试管内有试管内有红色沉淀红色沉淀产生产生Ⅰ、和Cu(OH)2反应CuSOCuSO44+2NaOH=+2NaOH=Cu(OH)Cu(OH)22↓↓+Na+Na22SOSO44此反应可以检验醛基存在注意:a氢氧化铜必须新制;b直接加热练习一练习一一个学生做乙醛的还原性实验时,取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1ml,在一支洁将的试管内混合后,向其中又加入5ml40%的乙醛,结果无红色沉淀出现。实验失败原因可能是()A、未充分加热B、加入乙醛太少C、加入NaOH溶液的量不够D、加入CuSO4溶液的量不够A、C三、乙醛的化学性质三、乙醛的化学性质22、乙醛的氧化反应、乙醛的氧化反应((33)被弱氧化剂氧化)被弱氧化剂氧化AgNOAgNO33溶液+稀氨水生成白色沉淀生成白色沉淀沉淀恰好沉淀恰好完全溶解完全溶解继续滴加氨水银氨溶液滴入3滴乙醛水浴加热试管内壁上附有一层试管内壁上附有一层光亮如镜的金属银光亮如镜的金属银1、检验醛基的存在2、工业上利用这个反应,把银均匀地镀在玻璃上制镜或者保温瓶胆Ⅱ、银镜反应三、乙醛的化学性质三、乙醛的化学性质22、乙醛的氧化反应、乙醛的氧化反应CHCH33CHO+2[Ag(NHCHO+2[Ag(NH33))22]OHCH]OHCH33COONHCOONH44++3NH3NH33+2Ag+2Ag↓↓+H+H22OO△△cc被弱氧化剂氧化被弱氧化剂氧化解释:解释:银被还原,乙醛被氧化成乙酸,乙酸又和氨银被还原,乙醛被氧化成乙酸,乙酸又和氨反应生成乙酸铵。反应生成乙酸铵。制银氨溶液:制银氨溶液:AgNOAgNO33+NH+NH33·H·H22O=AgOH↓+O=AgOH↓+NHNH44NONO33AgOH+2NHAgOH+2NH33·H·H22O=[Ag(NHO=[Ag(NH33))22]OH+2H]OH+2H22OO氢氧化二氨合银(络合物)氢氧化二氨合银(络合物)银镜反应:银镜反应:银镜反应注意事项银镜反应注意事项•(1)试管内壁必须洁净;•(2)60℃水浴加热,不能用酒精灯直接加热;•(3)加热时不可振荡和摇动试管;•(4)须用新配制的银氨溶液,氨水不能过量(防此生成易爆炸的物质);•(5)乙醛用量不可太多;•(6)实验后,银镜用HNO3浸泡,再用水洗。乙醛性质的小节:1、加成反应醛+H2醇2、氧化反应a燃烧b催化氧化c被弱氧化剂氧化(银氨溶液、新制的Cu(OH)2)乙酸d使酸性高锰酸钾溶液、溴水褪色练习二练习二已知:柠檬醛的结构为:CH2CHCH2CH3CH3COHCCH3CCH如何证明存在碳碳双键?先加足量的银...