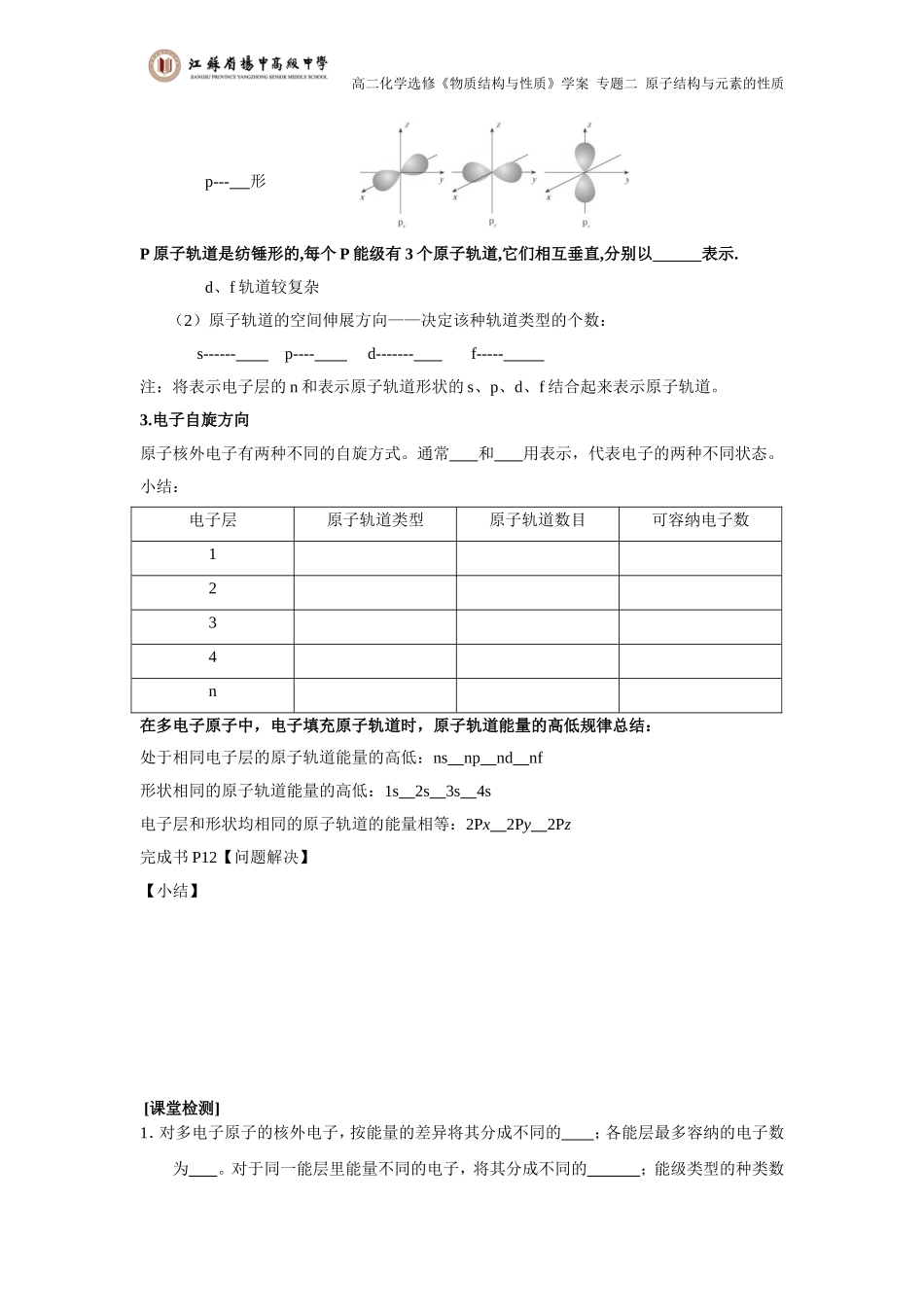
高二化学选修《物质结构与性质》学案专题二原子结构与元素的性质第1课时原子核外电子的运动特征[教学目标]1、了解核外电子的运动状态2、了解原子结构的构造原理,知道原子核外的能级分布[学习内容]知识回顾1.原子序数:(1)原子序数与构成原子的粒子间的关系:原子序数===(2)原子组成的表示方法a.原子符号:AzXAZ质量数(A)=b.原子结构示意图:c.电子式:2.核外电子排布的规律:①核外电子分层排布,总是尽先排在能量低的电子层里。②每层最多容纳电子数2n2(n表示电子层数)最外层电子数目不超过8个(第一层不超过2个)次外层电子数目不超过18个,倒数第三层电子数目不超过32个。新授一、人类对原子结构的认识电子云:二、原子核外电子的运动特征1.电子层(n)1234567符号离核→,能量→。2.原子轨道(能级、电子亚层)分类:分类依据:同一电子层中电子运动的能量仍有区别,电子云的形状也不相同(1)原子轨道形状——决定轨道的类型s----形S原子轨道是球形对称的,原子核位于球心,能层序数越大,原子轨道的半径就。高二化学选修《物质结构与性质》学案专题二原子结构与元素的性质p---形P原子轨道是纺锤形的,每个P能级有3个原子轨道,它们相互垂直,分别以表示.d、f轨道较复杂(2)原子轨道的空间伸展方向——决定该种轨道类型的个数:s------p----d-------f-----注:将表示电子层的n和表示原子轨道形状的s、p、d、f结合起来表示原子轨道。3.电子自旋方向原子核外电子有两种不同的自旋方式。通常和用表示,代表电子的两种不同状态。小结:电子层原子轨道类型原子轨道数目可容纳电子数1234n在多电子原子中,电子填充原子轨道时,原子轨道能量的高低规律总结:处于相同电子层的原子轨道能量的高低:nsnpndnf形状相同的原子轨道能量的高低:1s2s3s4s电子层和形状均相同的原子轨道的能量相等:2Px2Py2Pz完成书P12【问题解决】【小结】[课堂检测]1.对多电子原子的核外电子,按能量的差异将其分成不同的;各能层最多容纳的电子数为。对于同一能层里能量不同的电子,将其分成不同的;能级类型的种类数高二化学选修《物质结构与性质》学案专题二原子结构与元素的性质与能层数相对应;同一能层里,能级的能量按的顺序升高,即E(s)<E(p)<E(d)<E(f)。2.以下能级符号正确的是()A.6sB.2dC.3fD.7p3.下列能级中轨道数为5的是()A.s能级B.p能级C.d能级D.f能级4.下列各组多电子原子的原子轨道能量比较不正确的是()A.3px=3pzB.4s<3dC.4p>4fD.7s<6d5.比较下列多电子原子的原子轨道的能量高低(1)1s,3d(2)3s,3p,3d(3)2p,3p,4p6.第4电子层包含的原子轨道类型有,原子轨道数是,最多可容纳的电子数为。第n电子层所包含的原子轨道数是,最多可容纳的电子数为。7.下面是s能级p能级的原子轨道图,试回答问题:(1)s电子的原子轨道呈形,每个s能级有个原子轨道;p电子的原子轨道呈形,每个p能级有个原子轨道。(2)s电子原子轨道、p电子原子轨道的半径与什么因素有关?是什么关系?