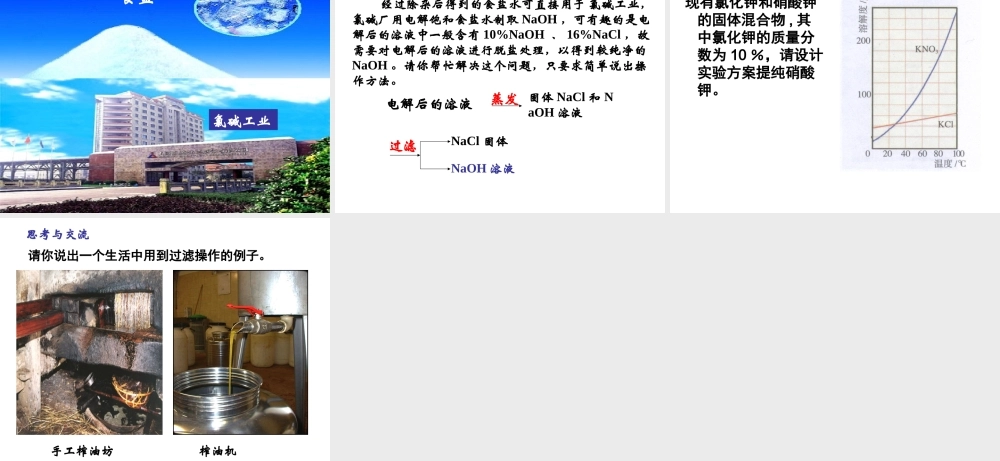
常用危险化学品的标志 化学实验基本方法过滤和蒸发 海 水 晒 盐海盐岩盐湖盐井盐 粗 盐 不溶性的泥沙,可溶性的 CaCl2 、 MgCl2 以及一些硫酸盐等。讨论海水的化学组成示意图粗盐中含有哪些杂质? 设计实验:如何除去食盐中混有的杂质?第一步 溶解:称取约 4 g 粗盐加到盛有约 12 mL 水的烧杯中,边加边用玻璃棒搅拌,直至粗盐不再溶解为止。实验现象:固体食盐逐渐溶解而减少,食盐水略显浑浊 第二步 过滤: 将烧杯中的液体沿玻璃棒倒入过滤器中, 过滤器中的液面不能超过滤纸的边缘。 若滤液浑浊,再过滤一次 实验现象:不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一个烧杯中 思考:滤液中是否含有杂质离子?演示:取少量滤液加入试管中,先滴入几滴稀盐酸,然后向试管中滴入几滴 BaCl2 溶液,观察现象。实验现象:滴入盐酸后,无新现象产生,再加 BaCl2 溶液,则有白色沉淀生成。解释及结论:在溶液中解离时能产生 SO42- 的化合物与 BaCl2 溶液反应,生成不溶于稀盐酸的白色沉淀 BaSO4 ,即说明有 SO42- 存在。利用这一反应可以检验硫酸和可溶性硫酸盐。如: Na2SO4+BaCl2=BaSO4↓+2NaCl 第三步 除去可溶性杂质( CaCl2 、 MgCl2 以及一些硫酸盐) 思考:应加入什么试剂?一些物质的溶解性资料:OH-Cl-SO4 2-CO3 2-H+溶、挥溶溶、挥Na+溶溶溶溶Ca2+微溶微不Ba2+溶溶不不Mg2+不溶溶微不不不不 由此除去粗盐中的杂质离子的正确操作的分析过程如下: OH- CO32- Ba2+CO32- Mg2+ Ca2+ SO42- 特征除杂试剂OH-Ba2+CO32-Na+Na+Cl-过量的除杂试剂 CO32-Na+H+ Cl-H+ Cl-控制 pHNa+ 、 Cl- 请大家归纳一下,除去粗盐中可溶性杂质,试剂的加入顺序共有几种?依据是什么?思考与交流( 1 ) BaCl2——Na2CO3——NaOH——HCl( 2 ) BaCl2——NaOH——Na2CO3——HCl( 3 ) NaOH——BaCl2——Na2CO3——HCl依据: Na2CO3 在 BaCl2 之后加入, Na2CO3 除 CaCl2 和 BaCl2 。 稀盐酸最后加入。 第五步 蒸发:将除杂后的滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,待出现较多固体时停止加热。 实验现象:水份蒸发,逐渐析出白色固体 第四步 过滤:将烧杯中混合物静置,先将上层清液转移到过滤器中,然后再将烧杯中的白色沉淀和剩余溶液沿玻璃棒一齐倒入过滤器中。再向滤液中滴加过量的稀盐酸。实验现象:滤纸上留有白色沉淀,滤液澄清透明...