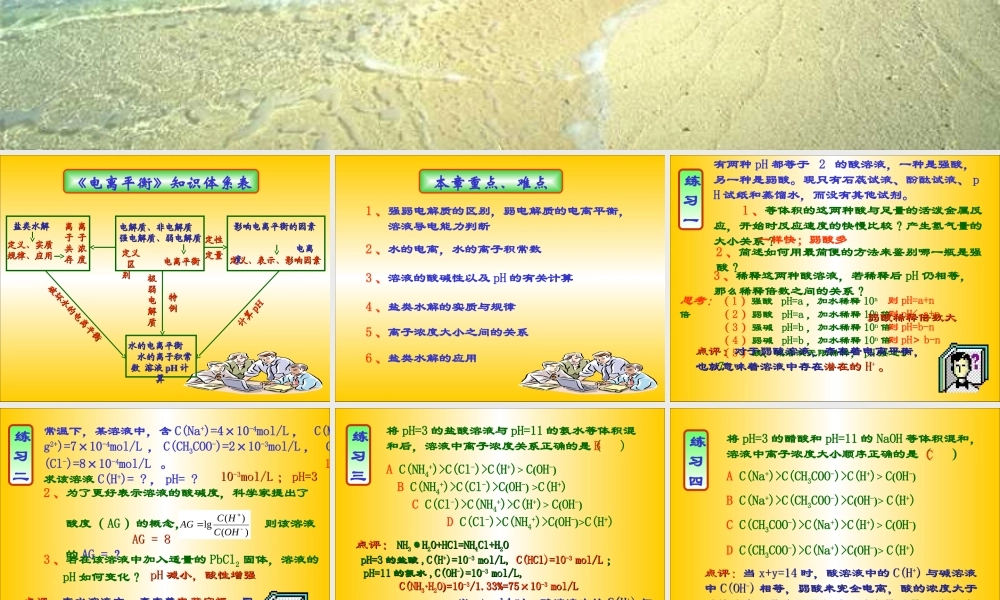
《电离平衡》知识体系表电解质、非电解质 电解质、非电解质 强电解质、弱电解质强电解质、弱电解质定义 定义 区 区别别电离平衡电离平衡影响电离平衡的因素 影响电离平衡的因素 电离电离度度定义、表示、影响因素定义、表示、影响因素盐类水解盐类水解定义、实质定义、实质规律、应用规律、应用离离子子共共存存离离子子浓浓度度水的电离平衡 水的电离平衡 水的离子积常 水的离子积常数 溶液数 溶液 pHpH 计计算算极极弱弱电电解解质质特特例例定性定性定量定量破坏水的电离平衡破坏水的电离平衡计算计算 pHpH 本章重点、难点1 、强弱电解质的区别,弱电解质的电离平衡, 溶液导电能力判断2 、水的电离,水的离子积常数3 、溶液的酸碱性以及 pH 的有关计算4 、盐类水解的实质与规律5 、离子浓度大小之间的关系6 、盐类水解的应用 练 习一有两种 pH 都等于 2 的酸溶液,一种是强酸,另一种是弱酸。现只有石蕊试液、酚酞试液、 pH 试纸和蒸馏水,而没有其他试剂。 1 、等体积的这两种酸与足量的活泼金属反应,开始时反应速度的快慢比较?产生氢气量的大小关系?2 、简述如何用最简便的方法来鉴别哪一瓶是强酸?思考:( 1 )强酸 pH=a ,加水稀释 10n倍则 pH=a+n( 2 )弱酸 pH=a ,加水稀释 10n 倍则 pH< a+n( 3 )强碱 pH=b ,加水稀释 10n 倍则 pH=b-n( 4 )弱碱 pH=b ,加水稀释 10n 倍则 pH> b-n( 5 )酸、碱溶液无限稀释, pH 接近于73 、稀释这两种酸溶液,若稀释后 pH 仍相等,那么稀释倍数之间的关系?点评:点评:对于弱酸溶液,存在着电离平衡,对于弱酸溶液,存在着电离平衡,也就意味着溶液中存在也就意味着溶液中存在潜在的潜在的 HH++ 。。一样快;弱酸多弱酸稀释倍数大弱酸稀释倍数大 练 习二点评:点评:在水溶液中,存在着在水溶液中,存在着电荷守恒电荷守恒。同。同时,溶液中存在时,溶液中存在 CHCH33COOCOO-- 离子,那么,溶液离子,那么,溶液中必然也存在中必然也存在 CHCH33COOHCOOH 分子。分子。常温下,某溶液中,含 C(Na+)=4×10-4mol/L , C(Mg2+)=7×10-4mol/L , C(CH3COO-)=2×10-3mol/L , C(Cl-)=8×10-4mol/L 。 1 、求该溶液 C(H+)= ? , pH= ?)()(lgOHCHCAG2 、为了更好表示溶液的酸碱度,科学家提出了 酸度( AG )的概念, 则该溶液 的 AG = ?3 、若在该溶液中加入适量的 PbCl2 固...