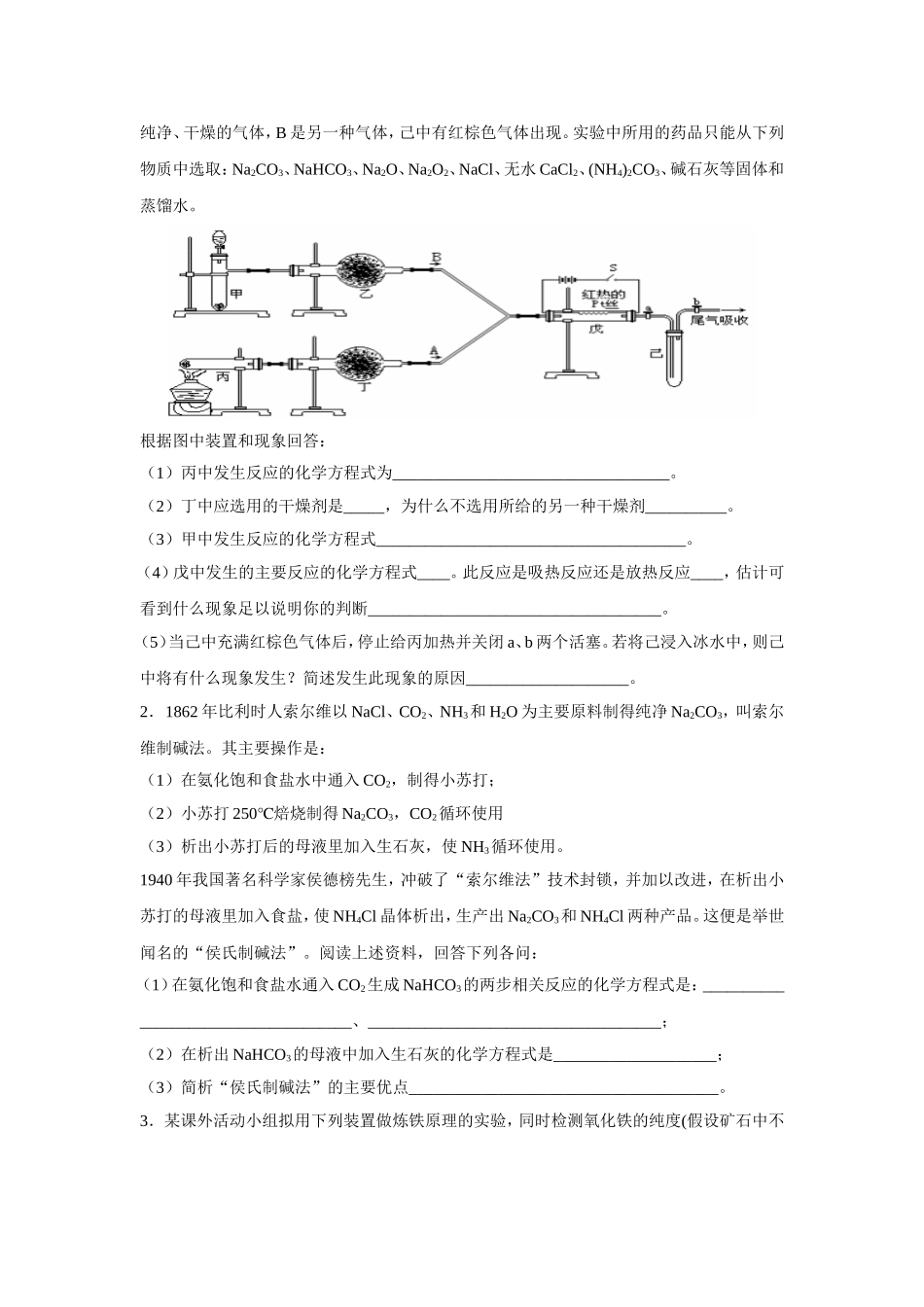
专题 化学实验基础2.实验室利用乙醇脱水制备乙烯的步骤如下; ① 在蒸馏烧瓶中加人 95%的乙醇和浓硫酸(体积比为 l:3),再加入少量碎瓷片; ② 瓶口插上带塞的温度计; ③ 加热并迅速使反应温度上升到 170℃; ④ 气体通过稀 NaOH 溶液进行洗气后,用酸性 KMnO4溶液检验乙烯的还原性。 据此回答下列问题: (1)步骤①中混合乙醇和浓硫酸时应注意的问题是 。 (2)在反应液中加入少量碎瓷片的作用是 。 (3)步骤②中温度计水银球的正确位置是 。 (4)加热时,使反应液温度迅速升高到 170℃的原因是 。 (5)步骤④中.用稀 NaOH 溶液洗涤气体,能除去可能伴随乙烯生成的气体是 ,写出产生此类气体的化学方程式 。3. 现有 W g 的混合气体,其主要成分是 CO、H2 和少量 CO2、水蒸气。请从下图中选用适当的实验装置设计一个实验,以确认上述混合气中含有 CO 和 H2,并计算 H2的质量分数。(1)应选用的装置(只要求写出图中的装置序号)__________________________。(2)所选用的装置的连接顺序应是(填各接口的字母,连接胶管省略)。混合气体→___________________ __。(3)确认混合气体中含 H2的实验现象_____________ _____________,理由是_______________ ____ ____。(4)实验前分别称装置⑥质量为 W1 g、装置⑤为 M1 g、装置②为 Z1 g。实验结束后再称各装置:装置⑥为 W2 g、装置⑤ M2 g、装置②为 Z2 g。若反应中生成物全被吸收,则 W g 混合气中H2的质量分数为__ _____。4. 实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A 为一种纯净、干燥的气体,B 是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水 CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。根据图中装置和现象回答:(1)丙中发生反应的化学方程式为__________________________________。(2)丁中应选用的干燥剂是_____,为什么不选用所给的另一种干燥剂__________。(3)甲中发生反应的化学方程式______________________________________。(4)戊中发生的主要反应的化学方程式____。此反应是吸热反应还是放热反应____,估计可看到什么现象足以说明你的判断____________________________________。(5)当己中充满红棕色气体后,停止给丙加热并关闭 a、b 两个活塞。若将己浸入冰水中,则己中将有什么...