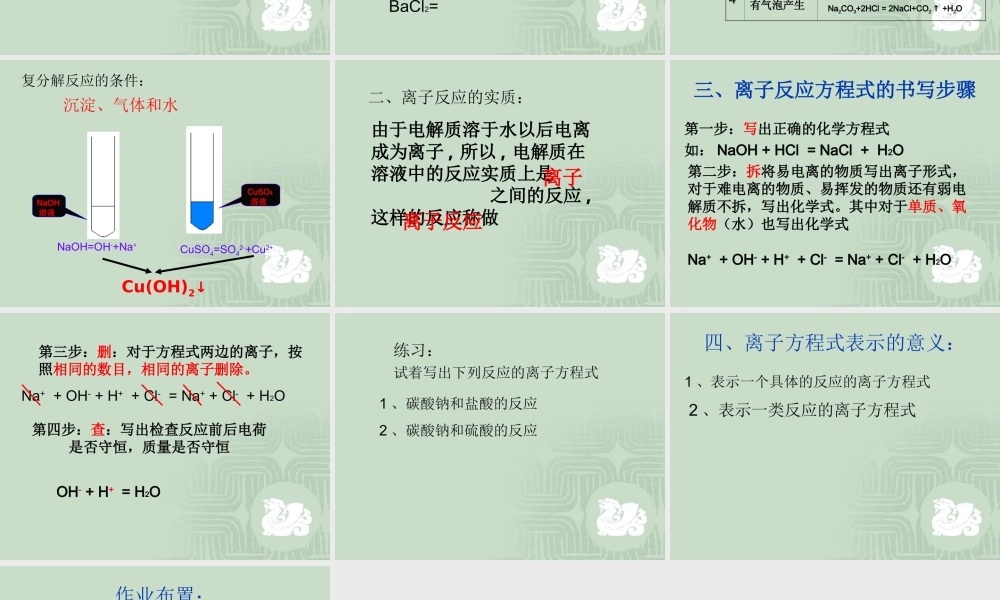
第二节 离子反应隆德县高级中学 朱小军学习目标 了解电解质的概念,知道酸碱盐在水溶液中可以电离。初步会写电离方程式。 掌握离子反应的实质 初步学会按书写离子反应的步骤书写离子反应方程式 初步会判断离子共存一、酸、碱、盐在水溶液中的电离酸、碱、盐在水溶液中在水分子的作用下,发生了离解,我们把这个过程叫电离 , 我们将在熔融状态或水溶液中能电离的物质叫电解质,不能电离的物质叫非电解质。 1. 下列物质中哪些是电解质?哪些是非电解质? Cu 、 NaCl 固体、 CaCO3 、 K2SO4 溶液、 CO2 、蔗糖、 NaCl 溶液、酒精、活性炭、水。强酸:如 HCl 、 H2SO4 、 HNO3强碱:如 KOH 、 NaOH 、 Ba(OH)2大多数盐:如 NaCl 、 AgNO3 等强电解质弱酸:如 H2S 、 H2SO3 、 CH3COOH 等弱碱:如 NH3 H2O 、 Cu(OH)2 等水: H2O弱电解质电解质能够完全电离的为强电解质,部分电离的为弱电解质NaCl = Na+ + Cl-对于电离的过程,我们用电离方程式来表示:如请同学们试着写出下列物质的电离方程式:HCl = NaOH= H2SO4= Cu(OH)2=BaSO4= BaCl2=实验及实验现象实验现象化学反应方程式1234无现象无有蓝色沉淀生产CuSO4+2NaOH = Na2SO4 +2Cu(OH)2↓加酚酞溶液变红,加入盐酸后红色逐渐变浅,最后变为无色.NaOH+HCl = NaCl+H2O有气泡产生Na2CO3+2HCl = 2NaCl+CO2 ↑ +H2ONaOH溶液 CuSO4溶液 NaOH=OH-+Na+CuSO4=SO42-+Cu2+Cu(OH)2↓复分解反应的条件:沉淀、气体和水二、离子反应的实质:由于电解质溶于水以后电离成为离子 , 所以 , 电解质在溶液中的反应实质上是 之间的反应 ,这样的反应称做离子反应离子三、离子反应方程式的书写步骤第一步:写出正确的化学方程式如: NaOH + HCl = NaCl + H2O第二步:拆将易电离的物质写出离子形式,对于难电离的物质、易挥发的物质还有弱电解质不拆,写出化学式。其中对于单质、氧化物(水)也写出化学式Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O第三步:删:对于方程式两边的离子,按照相同的数目,相同的离子删除。Na+ + OH- + H+ + Cl- = Na+ + Cl- + H2O第四步:查:写出检查反应前后电荷是否守恒,质量是否守恒OH- + H+ = H2O练习:试着写出下列反应的离子方程式1 、碳酸钠和盐酸的反应2 、碳酸钠和硫酸的反应四、离子方程式表示的意义:1 、表示一个具体的反应的离子方程式2 、表示一类反应的离子方程式作业布置: