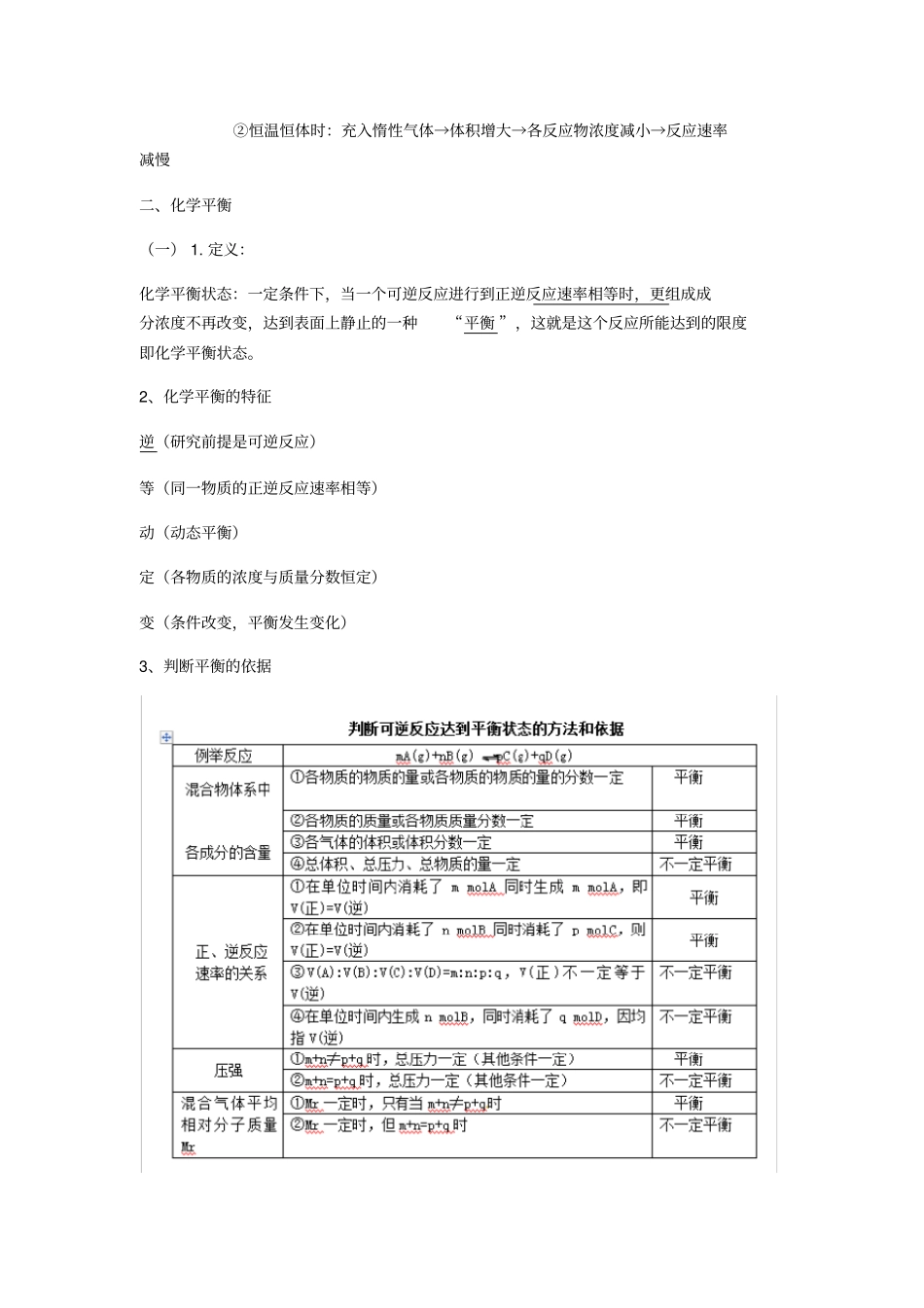
?化学反应速率与化学平衡知识点归纳?一、化学反应速率?1. 化学反应速率( v)?⑴ 定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化?⑵ 表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示?⑶ 计算公式: v=Δc/ Δt (υ :平均速率,Δ c:浓度变化,Δ t :时间)单位:mol/ (L·s)?⑷ 影响因素:?① 决定因素(内因):反应物的性质(决定因素)?② 条件因素(外因):反应所处的条件?2. ※注意:( 1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变(2)、惰性气体对于速率的影响①恒温恒容时:充入惰性气体→总压增大,但是各分压不变,各物质浓度不变→反应速率不变②恒温恒体时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一) 1. 定义:化学平衡状态:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡 ”,这就是这个反应所能达到的限度即化学平衡状态。2、化学平衡的特征逆(研究前提是可逆反应)等(同一物质的正逆反应速率相等)动(动态平衡)定(各物质的浓度与质量分数恒定)变(条件改变,平衡发生变化)3、判断平衡的依据(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡_不移动 _ (3)在溶液中进行的反应,如果稀释溶液,反应物浓度__减小 __,生成物浓度也 _减小_, V 正_减小 __,V 逆也_减小 __,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着___吸热反应 ______方向移动,温度降低会使化学平衡向着_放热反应 __方向移动。3、压强对化学平衡移动的影响影响规律:其他条件不变时,增大压强,会使平衡向着__体积缩小 ___方向移动;减小压强,会使平衡向着___体积增大 __方向移动。注意:( 1)改变压强不能使无气态物质存在的化学平衡发生移动(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似4. 催化剂对化学平衡的影响:由于使用催化剂...