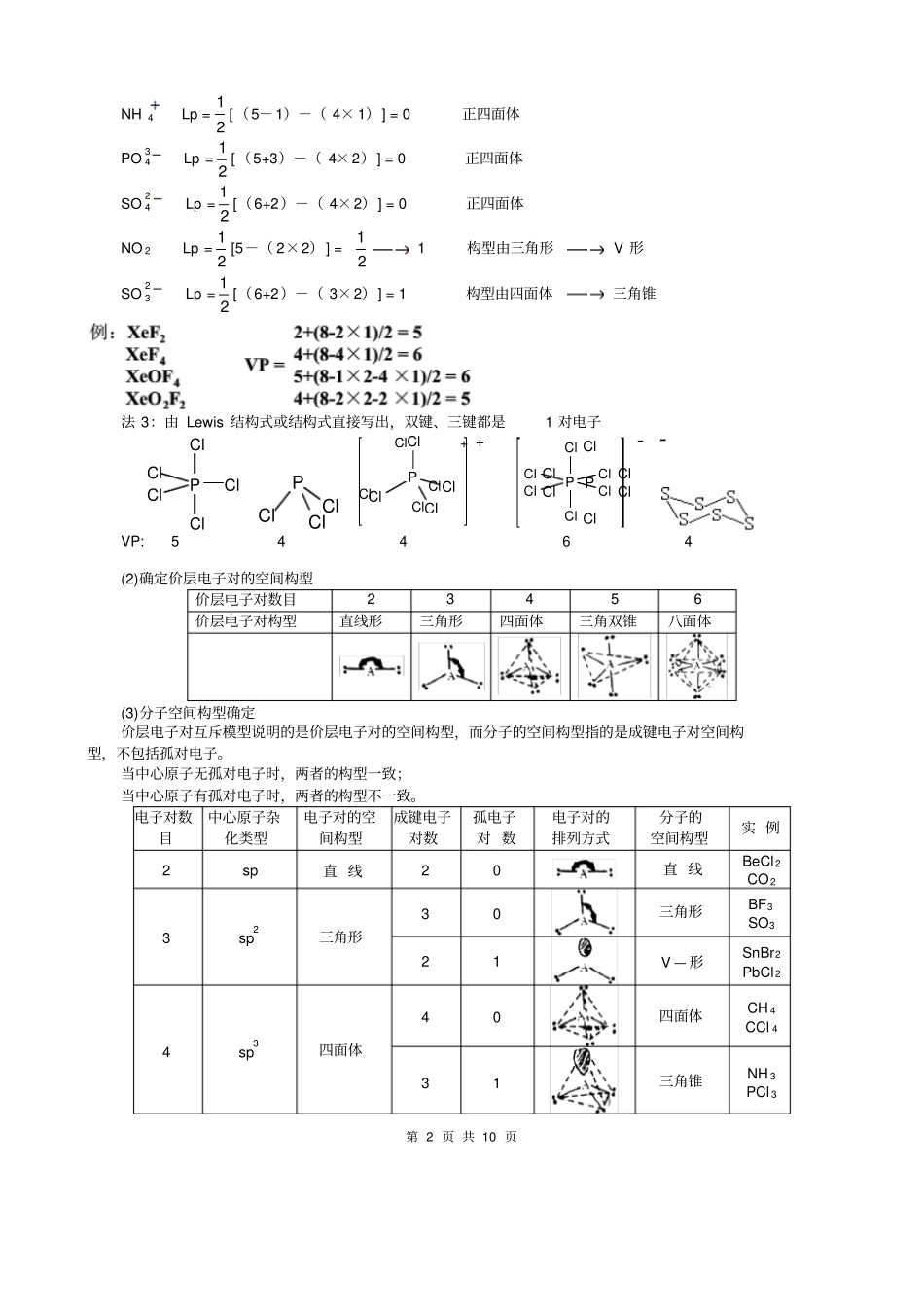
第 1 页 共 10 页选修三第二章第 2 节分子的立体构型第 2 节分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O2、N2 等。2.三原子分子有直线形,如CO2、CS2 等;还有“ V”形,如 H 2O、 H2S、SO2 等。3.四原子分子有平面三角形,如BF3、BCl 3、CH 2O 等;有三角锥形,如NH 3、 PH3 等;也有正四面体,如P4。4.五原子分子有正四面体,如CH 4、CCl 4 等,也有不规则四面体,如CH3Cl 、CH2Cl 2、CHCl 3。另外乙烯分子和苯分子都是平面形分子。二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称 VSEPR 适用 AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤:(1)确定中心原子A 价层电子对数目法 1.经验总结中心原子的价层电子对数=21 (中心离子价电子数+配对原子提供电子总数)对于 AB m 型分子 (A 为中心原子, B 为配位原子 ),计算方法如下:n=中心原子的价电子数+每个配位原子提供的价电子数×m2注意:①氧族元素的氧做中心时:价电子数为6, 如 H 2O,H2S;做配体时 :提供电子数为0,如在 CO 2中。②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。如 PO34 中 P 原子价层电子数5+(0×4) +3 = 8;NH 4中 N 原子的价层电子数5+(1×4)- 1 = 8。③结果为单电子时视作有一个电子对。例: IF5价层电子对数为21 [7+ (5×1)] = 6 对正八面体(初步判断)N H 4价层电子对数为21 [5+(4×1)- 1] = 4 对正四面体PO34价层电子对数为21[5+ (0×4) +3] = 4 对正四面体NO 2 价层电子对数为21[5+0] = 2.53 对平面三角形法 2. 确定中心原子A 价层电子对数目----- 普遍规则中心原子 A 价层电子对数目=成键电子对数 +孤对电子数 ( VP = BP + LP )VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR )VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP =配位原子数 +LP Lp = 21 (中心原子价电子数—配位原子未成对电子数之和) IF 5Lp=21[7-(5× 1)] = 1 构型由八面体四方锥第 2 页 共 10 页NH 4Lp =21[(5-1)-( 4× ...