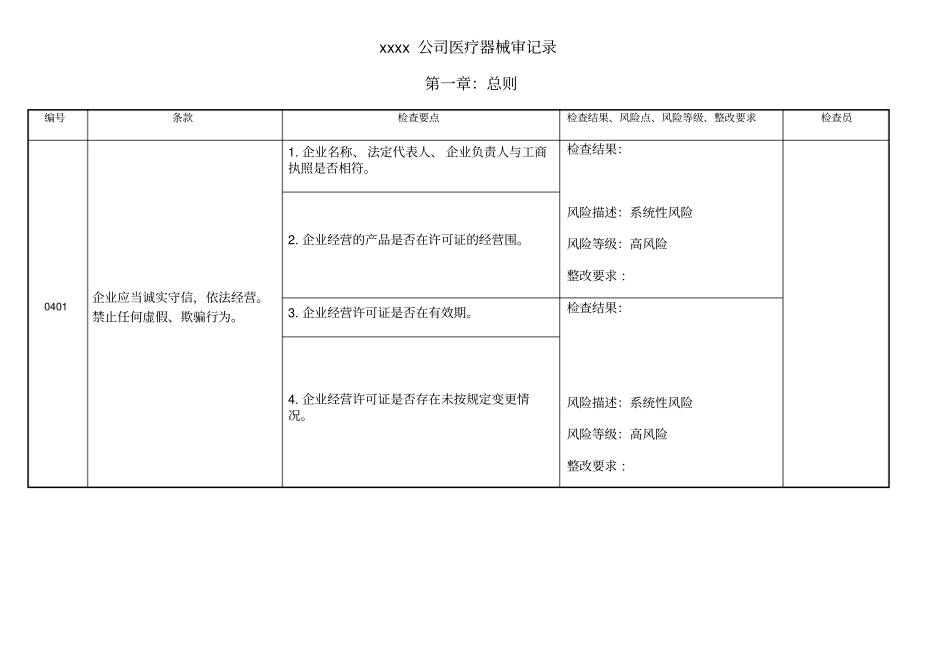
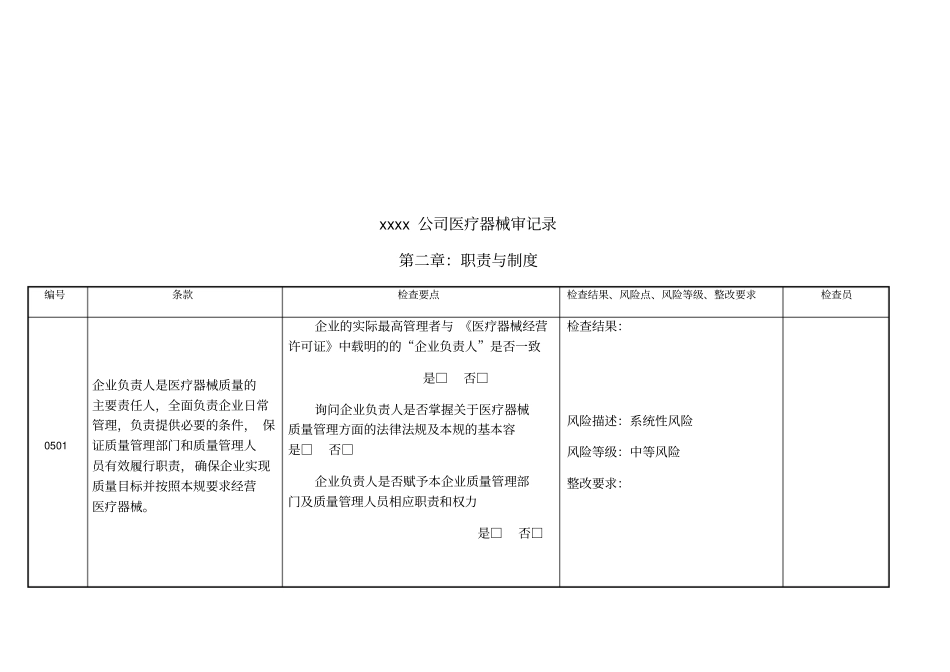
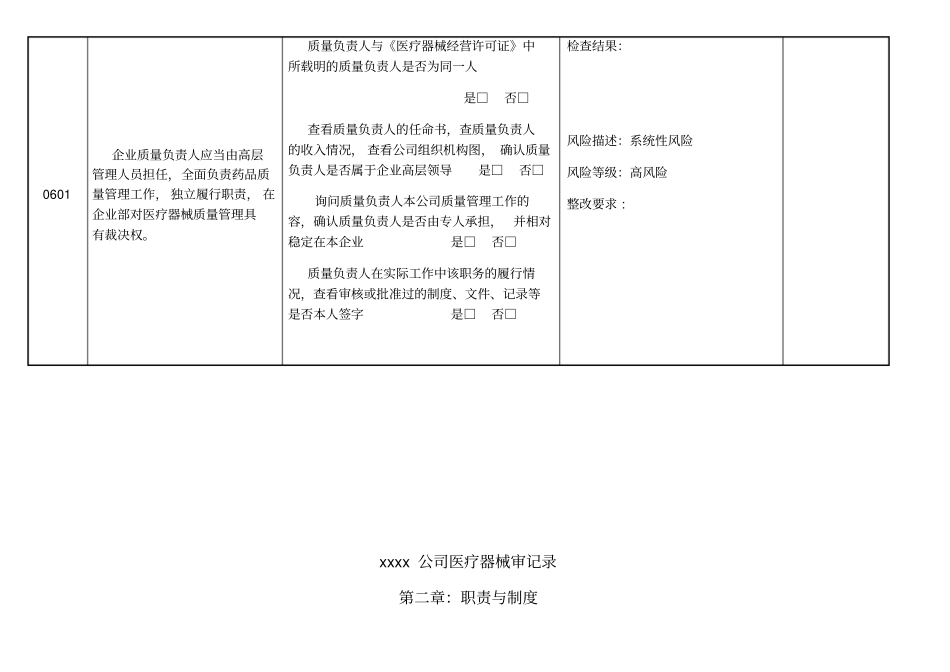
xxxx 公司医疗器械审记录第一章:总则编号条款检查要点检查结果、风险点、风险等级、整改要求检查员0401 企业应当诚实守信,依法经营。禁止任何虚假、欺骗行为。1. 企业名称、 法定代表人、 企业负责人与工商执照是否相符。检查结果:风险描述:系统性风险风险等级:高风险整改要求 :2. 企业经营的产品是否在许可证的经营围。3. 企业经营许可证是否在有效期。检查结果:风险描述:系统性风险风险等级:高风险整改要求 :4. 企业经营许可证是否存在未按规定变更情况。xxxx 公司医疗器械审记录第二章:职责与制度编号条款检查要点检查结果、风险点、风险等级、整改要求检查员0501 企业负责人是医疗器械质量的主要责任人,全面负责企业日常管理,负责提供必要的条件, 保证质量管理部门和质量管理人员有效履行职责,确保企业实现质量目标并按照本规要求经营医疗器械。企业的实际最高管理者与 《医疗器械经营许可证》中载明的的“企业负责人”是否一致是□否□询问企业负责人是否掌握关于医疗器械质量管理方面的法律法规及本规的基本容是□否□企业负责人是否赋予本企业质量管理部门及质量管理人员相应职责和权力是□否□检查结果:风险描述:系统性风险风险等级:中等风险整改要求:0601企业质量负责人应当由高层管理人员担任,全面负责药品质量管理工作, 独立履行职责, 在企业部对医疗器械质量管理具有裁决权。质量负责人与《医疗器械经营许可证》中所载明的质量负责人是否为同一人是□否□查看质量负责人的任命书,查质量负责人的收入情况, 查看公司组织机构图, 确认质量负责人是否属于企业高层领导是□否□询问质量负责人本公司质量管理工作的容,确认质量负责人是否由专人承担,并相对稳定在本企业是□否□质量负责人在实际工作中该职务的履行情况,查看审核或批准过的制度、文件、记录等是否本人签字是□否□检查结果:风险描述:系统性风险风险等级:高风险整改要求 :xxxx 公司医疗器械审记录第二章:职责与制度编号条款检查要点检查结果、风险点、风险等级、整改要求检查员0701 组织制订质量管理制度,指导、监督制度的执行。并对质量管理制度执行情况进行检查、 纠正和持续改进质量管理制度是否定期检查是□否□检查对存在问题是否提出纠正措施和预防措施;是□否□各部门是否落实纠正、 预防措施; 是□否□质量管理部门是否对采取纠正、 预防措施的具体情况及有效性进行跟踪检查;是□否□检查结果:风险描述:...